แคลเซียมไบคาร์บอเนต
| |
| ชื่อ | |
|---|---|
| IUPAC name
แคลเซียมไฮโดรเจนคาร์บอเนต
| |
| Systematic IUPAC name
Calcium bicarbonate | |
| ชื่ออื่น
Cleansing lime
Bicarbonate of lime Rain salt | |
| เลขทะเบียน | |
3D model (JSmol)
|
|
| เคมสไปเดอร์ | |
ผับเคม CID
|
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| คุณสมบัติ | |
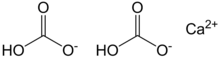
| Ca(HCO3)2 | |
| มวลโมเลกุล | 162.11464 g/mol |
| 16.1 g/100 mL (0 °C) 16.6 g/100 mL (20 °C) 18.5 g/100 mL (100 °C) แม่แบบ:Reference needed | |
| ความอันตราย | |
| อาชีวอนามัยและความปลอดภัย (OHS/OSH): | |
อันตรายหลัก
|
ระคายเคือง |
| จุดวาบไฟ | ไม่ติดไฟ |
| สารประกอบอื่นที่เกี่ยวข้องกัน | |
แคทไอออนอื่น ๆ
|
แมกนีเซียมไบคาร์บอเนต |
สารประกอบที่เกี่ยวข้อง
|
โซเดียมไบคาร์บอเนต |
หากมิได้ระบุเป็นอื่น ข้อมูลข้างต้นนี้คือข้อมูลสาร ณ ภาวะมาตรฐานที่ 25 °C, 100 kPa
| |
แคลเซียมไบคาร์บอเนต หรือ แคลเซียมไฮโดรเจนคาร์บอเนต (อังกฤษ: calcium bicarbonate; สูตรเคมี: Ca (HCO3)2) เป็นสารประกอบที่อยู่ในสารละลายเท่านั้น ถ้าสารละลายระเหยจะเกิดปฏิกิริยาดังนี้
แคลเซียมไบคาร์บอเนตจะเกิดก็ต่อเมื่อน้ำมีคาร์บอนไดออกไซด์ในสารละลาย (หรือเรียกว่า กรดคาร์บอนิก) ทำปฏิกิริยากับแคลเซียมคาร์บอเนต
ปฏิกิริยานี้มีความสำคัญมากในการเกิดหินงอก หินย้อย คอลัมน์ภายในถ้ำ น้ำที่มีคาร์บอนไดออกไซด์ในบรรยากาศผ่านลงไปตามหินปูน (limestone) หรือแคลเซียมคาร์บอเนตอื่น แคลเซียมคาร์บอเนตบางส่วนจะถูกเปลี่ยนไปเป็นไบคาร์บอเนตซึ่งละลายน้ำได้ดีมาก ต่อมาเมื่อน้ำแห้ง แคลเซียมไบคาร์บอเนตจะเปลี่ยนไปเป็นแคลเซียมคาร์บอเนต ซึ่งละลายน้ำได้น้อยจะแยกตัวออกมาเกาะเป็นหินงอกหินย้อย อุณหภูมิมีความสำคัญต่อปฏิกิริยามาก เพราะเมื่ออุณหภูมิสูง คาร์บอนไดออกไซด์จะแยกตัวออกจากสารละลายแคลเซียมคาร์บอเนตเร็วขึ้น
อ้างอิง[แก้]
- Baking Soda เก็บถาวร 2015-02-26 ที่ เวย์แบ็กแมชชีน
