ผลต่างระหว่างรุ่นของ "ยาปฏิชีวนะ"
Thomson Walt (คุย | ส่วนร่วม) |
Thomson Walt (คุย | ส่วนร่วม) |
||
| บรรทัด 524: | บรรทัด 524: | ||
[[File:Phage injecting its genome into bacteria.svg|thumb|200 px|การเข้าจับและสอดแทรก[[จีโนม]]ของฟาจเข้าสู่[[เซลล์]]ของ[[แบคทีเรีย]]]] |
[[File:Phage injecting its genome into bacteria.svg|thumb|200 px|การเข้าจับและสอดแทรก[[จีโนม]]ของฟาจเข้าสู่[[เซลล์]]ของ[[แบคทีเรีย]]]] |
||
[[เฟจเพื่อการรักษาโรค]] เป็นการรักษาอีกวิธีหนึ่งที่ถูกนำมาใช้ในการรักษา[[โรคติดเชื้อ|โรคที่เกิดจากการติดเชื้อ]][[แบคทีเรียดื้อยา|แบคทีเรียที่ดื้อต่อยาปฏิชีวนะ]] โดยการรักษาแบบเฟจเพื่อการรักษาโรคนี้จะเป็นการทำให้[[แบคทีเรีย]]ก่อโรคนั้นๆเกิดการติด[[ไวรัส|เชื้อไวรัส]]ที่มี[[แบคทีเรีย]]ดังกล่าวเป็นโฮสต์จำเพาะ โดย[[ไวรัส]]ดังกล่าวจัดเป็น[[แบคเทอริโอ |
[[เฟจเพื่อการรักษาโรค]] เป็นการรักษาอีกวิธีหนึ่งที่ถูกนำมาใช้ในการรักษา[[โรคติดเชื้อ|โรคที่เกิดจากการติดเชื้อ]][[แบคทีเรียดื้อยา|แบคทีเรียที่ดื้อต่อยาปฏิชีวนะ]] โดยการรักษาแบบเฟจเพื่อการรักษาโรคนี้จะเป็นการทำให้[[แบคทีเรีย]]ก่อโรคนั้นๆเกิดการติด[[ไวรัส|เชื้อไวรัส]]ที่มี[[แบคทีเรีย]]ดังกล่าวเป็นโฮสต์จำเพาะ โดย[[ไวรัส]]ดังกล่าวจัดเป็น[[แบคเทอริโอฟาจ]] (bacteriophage) หรือเรียกโดยย่อว่า '''ฟาจ''' เป็น[[ไวรัส]]ที่ต้องอาศัยอยู่กับ[[เซลล์]]ของ[[แบคทีเรีย]]เพื่อการเจริญและเพิ่มจำนวน โดยฟาจแต่ละชนิดจะมีความจำเพาะต่อ[[แบคทีเรีย]]สายพันธุ์ใดสายพันธุ์หนึ่งเป็นอย่างมาก ดังนั้นฟาจดังกล่าวจึงไม่ส่งผลกระทบต่อ[[จุลชีพ]]อื่นๆ หรือ[[จุลชีพประจำถิ่น]]ใน[[ทางเดินอาหาร]]ของโฮสต์ ซึ่งเป็นคุณสมบัติที่พบไม่ได้ในยาปฏิชีวนะที่มีใช้อยู่ในปัจจุบัน<ref name=":11" /> [[แบคเทอริโอฟาจ]]สามารถทำให้[[แบคทีเรีย]]ก่อโรคเกิดการติดเชื้อได้และส่งผลกระทบต่อ[[การเจริญเติบโต]]หรือฆ่า[[เซลล์]][[แบคทีเรีย]]นั้นๆ ได้โดยการทำให้เกิดการแตกออกของ[[เซลล์]] (lytic cycle)<ref name=":11" /><ref name=Sulakvelidze>{{Cite journal | author = Sulakvelidze, A. |author2=Alavidze, Z. |author3=Morris, Jr J. G. |year = 2001 | title = Bacteriophage Therapy | journal = Antimicrob Agents Chemother | volume = 45 | issue = 3 | pages = 649–659 | doi=10.1128/aac.45.3.649-659.2001 | pmid=11181338 | pmc=90351}}</ref> โดยฟาจจะเข้าจับกับ[[เซลล์]][[แบคทีเรีย]]และแทรกสอด[[ดีเอ็นเอ]]ของตนเข้าไปในเซลล์นั้น ซึ่ง[[ดีเอ็นเอ]]เหล่านั้นจะถูก[[การถอดรหัส (พันธุศาสตร์)|ถอดรหัส]][[พันธุกรรม]]และสังเคราะห์ส่วนประกอบชีวภาพของฟาจใหม่ขึ้นภายในเซลล์ของแบคทีเรีย ทำให้มีฟาจใหม่เกิดขึ้นภายในเซลล์แบคทีเรียจำนวนมาก จนเกิดการแตกออกของเซลล์นั้นๆในที่สุด โดยฟาจใหม่ที่เกิดขึ้นนี้จะเข้าทำลายเซลล์อื่นของแบคทีเรียในสายพันธ์ุเดิมด้วยกระบวนการข้างต้นต่อไป<ref name=Sulakvelidze/> การที่ฟาจมีความจำเพาะต่อแบคทีเรียสายพันธุ์หนึ่งๆเป็นอย่างมากนี้จะช่วยให้แบคทีเรียอื่นที่เป็นประโยชน์ต่อโฮสต์ไม่ถูกทำลายไปด้วย อย่างไรก็ตาม การใช้ฟาจในการรักษานี้ก็มีข้อเสียเช่นเดียวกันกับการรักษาด้วยวิธีอื่นๆ โดยจีโนมที่ฟาจแทรกสอดเข้ามาในเซลล์ของแบคทีเรียนั้นอาจมียีนหรือสารอื่นที่ก่อให้เกิดพิษสอดแทรกอยู่ ดังนั้น จึงต้องมีการศึกษาและจำแยกยีน สารประกอบหรือสารพิษต่างๆจากฟาจนั้นอย่างละเอียดและรอบคอบก่อนนำมาใช้ในทางคลินิก นอกจากนี้ การศึกษาเกี่ยวกับการรักษาโรคติดเชื้อแบคทีเรียด้วยฟาจนั้นพบว่าการบริหารยาทางช่องปากและการฉีดเข้าหลอดเลือดดำนั้นมีความเสี่ยงด้านความปลอดภัยที่สูงกว่าการบริหารยาโดยการทาบนพื้นผิว (topical application) และมีความกังวลเกียวกับการตอบสนองต่อ[[ระบบภูมิคุ้มกัน]]ที่ไม่แน่นอนต่อ[[ฟาจ]]ที่จัดเป็น[[แอนติเจน]]ต่อร่างกายนี้ รวมไปถึงอุปสรรคด้าน[[กฏหมาย]]และ[[จริยธรรม]]มากมายที่จำเป็นต้องได้รับการแก้ไขเพื่อให้รองรับและสอดคล้องกับการใช้[[เฟจเพื่อรักษาโรค]]<ref name=":11">{{Cite journal|last=Gill|first=Erin E.|last2=Franco|first2=Octavio L.|last3=Hancock|first3=Robert E. W.|date=1 January 2015|title=Antibiotic adjuvants: diverse strategies for controlling drug-resistant pathogens|journal=Chemical Biology & Drug Design|volume=85|issue=1|pages=56–78|doi=10.1111/cbdd.12478|issn=1747-0285|pmc=4279029|pmid=25393203}}</ref> ถึงกระนั้น การใช้[[แบคเทอริโอฟาจ]]เพื่อทดแทน[[ยาต้านจุลชีพ]]ในการรักษา[[โรคติดเชื้อ]]ที่เกิดจาก[[แบคทีเรียดื้อยา|เชื้อดื้อยาหลายชนิด]]ที่ไม่ตอบสนองต่อยาปฏิชีวนะแบบเดิมๆ ก็ยังคงเป็นตัวเลือกที่น่าสนใจแม้ว่าจะมีความท้าทายมากมายก็ตาม<ref name=":11" /><ref>{{Cite journal|last=Opal|first=Steven M.|date=16 December 2016|title=Non-antibiotic treatments for bacterial diseases in an era of progressive antibiotic resistance|journal=Critical Care (London, England)|volume=20|issue=1|pages=397|doi=10.1186/s13054-016-1549-1|issn=1466-609X|pmid=27978847|pmc=5159963}}</ref> |
||
===สารพฤกษเคมี=== |
===สารพฤกษเคมี=== |
||
รุ่นแก้ไขเมื่อ 16:37, 12 กุมภาพันธ์ 2561
| ยาปฏิชีวนะ | |
|---|---|
| ระดับชั้นของยา | |
 การทดสอบความไวของแบคทีเรีย Staphylococcus aureus ต่อยาปฏิชีวนะด้วยวิธี Kirby-Bauer disk diffusion method โดยยาปฏิชีวนะจะกระจายเข้าไปในจานเพาะเลี้ยงที่มีเชื้อแบคทีเรียอยู่และส่งผลยับยั้งการเจริญเติบโตของ S. aureus ทำให้เกิดวงยับยั้งเชื้อ (Zone of inhibition) ขึ้น | |
| In Wikidata |
ยาปฏิชีวนะ (อังกฤษ: Antibiotics จากภาษากรีซโบราณ αντιβιοτικά, antiviotika) หรือเรียกอีกชื่อหนึ่งว่า ยาฆ่าเชื้อแบคทีเรีย (Antibacterials) เป็นกลุ่มย่อยของยาอีกกลุ่มหนึ่งในกลุ่มยาต้านจุลชีพ (Antimicrobial drugs)[1] ซึ่งเป็นยาที่ถูกใช้ในการรักษาและป้องกันการติดเชื้อแบคทีเรีย[2][3] โดยอาจออกฤทธิ์ฆ่าหรือยับยั้งการเจริญเติบโตของแบคทีเรียอย่างใดอย่างหนึ่งหรือทั้งสอง ยาปฏิชีวนะบางชนิดอาจมีคุณสมบัติเป็นมีคุณสมบัติเป็นสารต้านโพรโทซัวได้ เช่น เมโทรนิดาโซล[4][5] ทั้งนี้ ยาปฏิชีวนะไม่มีฤทธิ์ในการต้านไวรัสที่เป็นสาเหตุของโรคต่างๆ เช่น ไข้หวัด หรือ ไข้หวัดใหญ่ เป็นต้น โดยยาที่มีฤทธิ์ต่อเชื้อไวรัสจะถูกจัดอยู่ในกลุ่มยาต้านไวรัส ซึ่งเป็นกลุ่มย่อยอีกกลุ่มหนึ่งของยาต้านจุลชีพ
ในบางครั้ง คำว่า ยาปฏิชีวนะ (ซึ่งหมายถึง "การต่อต้านชีวิต") ถูกนำมาใช้เพื่อสื่อความถึงสารใดๆที่นำมาใช้เพื่อต้านจุลินทรีย์[6] ซึ่งมีความหมายเดียวกันกับคำว่า ยาต้านจุลชีพ[7] บางแหล่งมีการใช้คำว่า ยาปฏิชีวนะ และ ยาฆ่าเชื้อแบคทีเรีย ในความหมายที่แยกจากกันไป โดยคำว่า ยา (สาร) ฆ่าเชื้อแบคทีเรีย จะสื่อความถึง สบู่ และน้ำยาฆ่าเชื้อ ขณะที่คำว่า ยาปฏิชีวนะ จะหมายถึงยาที่ใช้ในทางการแพทย์เพื่อฆ่าเชื้อแบคทีเรีย[8]
การพัฒนายาปฏิชีวนะเริ่มต้นในช่วงศตวรรษที่ 20[9] พร้อมกับการพัฒนาเรื่องการให้วัคซีนเพื่อป้องกันโรคจากเชื้อจุลชีพต่างๆ การเกิดขึ้นของยาปฏิชีวนะนำมาซึ่งการกำจัดโรคติดเชื้อแบคทีเรียต่างๆ ออกไปหลายชนิด เช่น กรณีของวัณโรคที่ระบาดในประเทศกำลังพัฒนา อย่างไรก็ตาม ด้วยประสิทธิภาพที่ดีและการเข้าถึงยาที่ง่ายนำไปสู่การใช้ยาปฏิชีวนะในทางที่ผิด [10][11][12] พร้อมๆกับการที่แบคทีเรียมีการพัฒนาจนกลายพันธุ์เป็นเชื้อแบคทีเรียที่ดื้อต่อยาปฏิชีวนะ[2][13] ปัญหาดังข้างต้นได้แพร่กระจายเป็นวงกว้าง จนเป็นปัญหาสำคัญของการสาธารณสุขในทุกประเทศทั่วโลก จนองค์การอนามัยโลก (World Health Organization) ได้ประกาศให้ปัญหาการดื้อยาของเชื้อแบคทีเรียเป็น "ปัญหาสำคัญเร่งด่วนที่สุดที่เกิดขึ้นในทุกภูมิภาคทั่วโลกและทุกคนล้วนจะต้องได้รับผลกระทบจากปัญหานี้ ไม่ว่าวัยใด หรือประเทศใดก็ตาม"[14]
ศัพทมูลวิทยา

คำว่า 'antibiosis' ซึ่งมีความหมายว่า "ต่อต้านชีวิต" ถูกนำมาใช้เป็นครั้งแรกโดยนักจุลชีววิทยาชาวฝรั่งเศส ฌอง ปอล วูยล์ลีแม็ง (Jean Paul Vuillemin) เพื่ออธิบายปรากฏการณ์การออกฤทธิ์ต้านเซลล์สิ่งมีชีวิตของยาปฏิชีวนะที่ถูกค้นพบในช่วงแรก[15][16][17] ทั้งนี้ได้มีการอธิบายปรากฏการณ์การเกิด 'antibiosis' ในแบคทีเรียขึ้นเป็นครั้งแรกในปี ค.ศ. 1877 เมื่อ หลุยส์ ปาสเตอร์ และ โรเบิร์ต คอค พบว่าแบคทีเรียสกุลบาซิลลัสในอากาศสามารถยับยั้งการเจริญเติบโตของแบคทีเรีย Bacillus anthracis ได้[16][18] ซึ่งต่อมาคำดังกล่าวได้ถูกเปลี่ยนเป็น 'antibiotic' โดย เซลมัน แวกส์มัน – นักจุลชีววิทยาชาวอเมริกัน เมื่อ ค.ศ. 1942[15][16][19]
คำว่า antibiotic นั้นปรากฏเป็นครั้งแรกในบทความวารสารทางการแพทย์ใน ปี ค.ศ. 1942 โดย เซลมัน แวกส์มัน และทีมนักวิจัยของเขา เพื่อใช้สื่อถึงสารที่มีความเจือจางสูงชนิดใดๆ ที่จุลชีพสายพันธุ์หนึ่งๆ สร้างขึ้นเพื่อต่อต้านหรือยับยั้งการเจริญเติบโตของจุลชีพสายพันธุ์อื่น[16][19] ซึ่งนิยามนี้จะไม่รวมสารที่ออกฤทธิ์ฆ่าแบคทีเรียแต่ไม่ได้ถูกสร้างขึ้นโดยจุลชีพ (เช่น น้ำย่อย และไฮโดรเจนเพอร์ออกไซด์) รวมไปถึงสารประกอบที่สังเคราะห์เลียนแบบสารที่ได้จากแบคทีเรีย เช่น ยากลุ่มซัลโฟนาไมด์ ในการนิยามความหายของคำว่า antibiotic หรือยาปฏิชีวนะในปัจจุบันนั้น จะหมายความรวมไปถึงยาใดๆก็ตามที่ออกฤทธิ์ฆ่าหรือยับยั้งการเจริญเติบโตของแบคทีเรีย ไม่ว่ายานั้นๆจะถูกสร้างจากจุลชีพหรือไม่ก็ตาม[20][21]
คำว่า "antibiotic" นั้นมีรากศัพท์จากคำ 2 คำ คือ anti ซึ่งมีความหมายว่า ต่อต้าน กับ βιωτικός (biōtikos) ที่มีความหายว่า "เหมาะกับชีวิต, มีชีวิต"[22] ซึ่งคำว่า βιωτικός นั้นก็เกิดจากคำ 2 คำ คือ βίωσις (biōsis) ที่แปลว่า "หนทางแห่งชีวิต"[23]และคำว่า βίος (bios) ที่หมายถึง "ชีวิต"[24][25] ส่วนอีกคำหนึ่งให้ความหมายเหมือน "antibiotic" คือคำว่า "antibacterial" ซึ่งมาจากภาษากรีก ἀντί (anti) ที่มีความหมายว่า "ต่อต้าน"[26] กับคำว่า βακτήριον (baktērion) ซึ่งแผลงมาจากคำว่า βακτηρία (baktēria) ซึ่งมีความหมายว่า "พลอง, กระป๋อง"[27] ทั้งนี้ เนื่องจากแบคทีเรียสายพันธุ์แรกที่ถูกค้นพบนั้นมีรูปร่างเป็นแท่งคล้ายรูปทรงของพลองหรือกระป๋อง[28]
ประวัติและการค้นพบ
การสกัดยาปฏิชีวนะจากรา
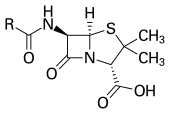
สารที่มีคุณสมบัติเป็นยาปฏิชีวนะนั้นถูกนำมาใช้ด้วยวัตถุประสงค์ที่หลากหลายนับตั้งแต่สมัยโบราณ ในช่วงก่อนคริสต์ศตวรรษที่ 20 การรักษาโรคติดเชื้อนั้นจะใช้ยาแผนโบราณเป็นหลัก โดยปรากฏมีการนำยาน้ำมิกซ์เจอร์ (Mixtures) ที่มีคุณสมบัติในการต้านจุลชีพมาใช้ในการรักษาโรคติดเชื้อเป็นเวลามากกว่า 2000 ปีที่แล้ว[29] อารยธรรมโบราณหลายแห่ง รวมถึงอียิปต์โบราณ และกรีซโบราณ มีการนำส่วนผสมหรือสารสกัดจากราและพืชสายพันธุ์ที่จำเพาะมารักษาโรคติดเชื้อชนิดต่างๆ[30][31] ส่วนการทดลองศึกษาในยุคถัดมานั้นมักทำขึ้นในห้องปฏิบัติการเพื่อทดลองและเฝ้าสังเกตการสังเคราะห์สารเพื่อต่อต้านซึ่งกันและกันในจุลชีพที่ต่างสายพันธ์กัน จนนำไปสู่การค้นพบยาต้านแบคทีเรียจากธรรมชาติที่สร้างจากจุลชีพในที่สุด หลุยส์ ปาสเตอร์ ได้ให้ข้อคิดเห็นและตั้งข้อสังเกตไว้ว่า "หากเราสามารถเข้าใจการต้านกันและกันระหว่างเชื้อแบคทีเรียบางชนิดได้ นั่นก็จะเป็นความหวังที่ยิ่งใหญ่ที่สุดสำหรับการรักษาโรคติดเชื้อ"[32]
ใน ค.ศ. 1874 นักฟิสิกส์ชาวเวลล์นามว่า เซอร์วิลเลียม โรเบิตส์ (Sir William Roberts) ได้เขียนบันทึกไว้ว่า ราสายพันธุ์Penicillium glaucum ที่ใช้ในการผลิตเนยแข็งสีน้ำเงินบางชนิดนั้นไม่มีการปนเปื้อนของแบคทีเรียเลย[33] ต่อมาในปี 1876 จอห์น ทินดอลล์ (John Tyndall) – นักฟิสิกส์ชาวอังกฤษสันนิษฐานว่าราสกุลดังกล่าวนั้นอาจมีการผลิตสารบางชนิดที่ส่งผลยับยั้งการเจริญเติบโตของแบคทีเรียได้[34] ซึ่งต่อมาปาสเตอร์ได้ทำการศึกษาประเด็นดังกล่าวและพบว่า แบคทีเรียสายพันธุ์ Bacillus anthracis นั้นจะไม่เจริญเติบโตในสภาวะที่มีราสายพันธุ์ Penicillium notatum อยู่[16][18]
ใน ค.ศ. 1895 วินเซนโซ ติเบริโอ (Vincenzo Tiberio) – นักฟิสิกส์ชาวอิตาลี ได้ตีพิมพ์บทความทางวารสารที่มีเนื้อหาเกี่ยวกับประสิทธิภาพในการต้านแบคทีเรียของสารสกัดจากราบางสายพันธุ์[35] ต่อมา ค.ศ. 1897 นักเรียนแพทย์ชาวฝรั่งเศส เออร์เนสต์ ดูเชส (Ernest Duchesne) ได้เสนอวิทยานิพนธ์เรื่อง "Contribution à l'étude de la concurrence vitale chez les micro-organismes: antagonisme entre les moisissures et les microbes" (การมีส่วนร่วมในการศึกษาเกี่ยวกับการแข่งขันที่เกี่ยวเนื่องกับชีวิตในจุลินทรีย์: การต้านกันของราและจุลชีพ)[36] ซึ่งถือเป็นนักวิชาการคนแรกที่พบว่าความสามารถในการรักษาโรคของรานั้นเป็นผลมาจากฤทธิ์ต้านแบคทีเรียของราเหล่านั้น ในวิทยานิพนธ์ฉบับนี้ ดูเชสได้ให้เสนอไว้ว่าแบคทีเรียและรานั้นมีการต่อสู้เพื่อความอยู่รอดกันอยู่ตลอดเวลา โดยดูเชสพบว่า แบคทีเรีย E. coli นั้นสามารถถูกกำจัดได้โดยราสายพันธุ์ Penicillium glaucum เมื่อทำการเพาะเลี้ยงจุลชีพทั้งสองในจานเพาะเลี้ยงเดียวกัน นอกจากนี้เขายังพบว่า เมื่อทำการให้เชื้อแบคทีเรียสกุลบาซิลลัสที่เป็นสาเหตุของไข้ไทฟอยด์ พร้อมกับรา Penicillium glaucum แก่สัตว์ทดลองโดยการสูดพ่น พบว่าสัตว์ทดลองนั้นๆไม่ปรากฏอาการและอาการแสดงของไข้ไทฟอยด์ แต่ช่างเป็นที่น่าเสียดายที่ หน่วยบริการทางการทหารที่ดูเชสสังกัดไม่อนุญาตให้เขาทำการศึกษาต่อเนื่องเพิ่มเติมในประเด็นดังกล่าวหลังจากที่เขาจบการศึกษา[37] ภายหลังดูเชสได้เสียชีวิตจากวัณโรค ซึ่งต่อมาก็เป็นอีกโรคหนึ่งที่สามารถรักษาให้หายขาดได้โดยยาปฏิชีวนะ[37]

ต่อมาในปี ค.ศ. 1928, เซอร์ อเล็กซานเดอร์ เฟลมมิง ได้ค้นพบเพนิซิลลิน ซึ่งเป็นสารที่ถูกสร้างขึ้นมาโดยราเพื่อฆ่าหรือหยุดการเจริญเติบโตของแบคทีเรียบางชนิด เฟลมมิงทำงานเพื่อช่วยเหลือทหารที่บาดเจ็บจากสงครามและมีการติดเชื้อแบคทีเรียของแผล ในการเพาะเชื้อแบคทีเรียก่อโรคเขาได้ค้นพบโดยบังเอิญว่าถาดเพาะเชื้อแบคทีเรียก่อโรคในบริเวณที่มีการปนเปื้อนรานั้นไม่มีการเจริญของแบคทีเรียดังกล่าว ซึ่งต่อมาทราบภายหลังว่ารานั้นคือสายพันธุ์ Penicillium chrysogenum [39] เฟลมมิงได้ตั้งสมมติฐานว่าราดังกล่าวอาจหลั่งสารบางอย่างที่มีฤทธิ์ในการต้านแบคทีเรีย เขาได้นำถาดเพาะเชื้อชิ้นนั้นไปเพาะเลี้ยงต่อ แล้วพบว่าเชื้อรานั้นได้ฆ่าแบคทีเรียที่ก่อให้เกิดโรคหลายชนิด และเขาได้ตั้งชื่อสารนั้นว่า เพนิซิลลิน เมื่อวันที่ 7 มีนาคม ค.ศ. 1929 เฟลมมิงเชื่อว่าคุณสมบัติในการต้านแบคทีเรียของสารนี้นั้นอาจเป็นประโยชน์ต่อการรักษาโรคติดเชื้อต่างๆ เขาจึงได้เริ่มศึกษาถึงคุณสมบัติทางชีววิทยาของเพนิซิลลินและพยายามที่จะใช้สารสกัดอย่างหยาบ (crude preparation) ที่ได้จากการศึกษาเพื่อรักษาโรคที่เกิดจากการติดเชื้อแบคทีเรียบางชนิด แต่อย่างไรก็ตาม เขาไม่สามารถพัฒนาสารนี้เพิ่มเติมต่อไปได้เนื่องจากไม่มีความช่วยเหลือนักเคมีที่มีความรู้และประสบการณ์[40][41]
เอินซต์ เชน (Ernst Chain), ฮาเวิร์ด ฟลอเรย์ (Howard Florey) และเอ็ดเวิร์ด อับราฮัม (Edward Abraham) เป็นนักวิทยาศาสตร์กลุ่มแรกที่ประสบความสำเร็จในการสกัดเพนิซิลลินบริสุทธิ์จากราได้ในปี ค.ศ. 1942 โดยยาที่สกัดได้นั้นคือ เบนซิลเพนิซิลลิน (G) แต่ยาดังกล่าวไม่ได้ถูกนำมาใช้ในการรักษาโรคในวงกว้าง โดยจำกัดการใช้อยู่เพียงแต่ภายในกองทัพเท่านั้น แต่หลังจาก ค.ศ. 1945 เป็นต้นมา นอร์มัน ฮีธลีย์ (Norman Heatley) ได้พัฒนาเทคนิคการสกัดแบบย้อนกลับ (back extraction technique) เพื่อให้สกัดเพนิซิลลินในปริมาณมากได้อย่างมีประสิทธิภาพ โดยผู้ที่สามารถถอดแบบโครงสร้างของเพนิซิลลินได้เป็นคนแรกนั้น คือ เอ็ดเวิร์ด อับราฮัม โดยสามารถระบุโครงสร้างที่แน่ชัดดังกล่าวได้ราวปี ค.ศ. 1942[42] ซึ่งสอดคล้องกับการอธิบายถึงโครงสร้างดังกล่าวในบทความตีพิมพ์ของโดโรธี ฮอดจ์กิน – นักชีวเคมีชาวบริติช เมื่อปี ค.ศ. 1945 โดยเพนิซิลลินสกัดบริสุทธิ์นี้สามารถออกฤทธิ์ต้านแบคทีเรียหลากหลายสายพันธุ์ได้อย่างมีประสิทธิภาพ และก่อให้เกิดพิษต่อมนุษย์ต่ำ นอกจากนี้ ฤทธิ์ของยาดังกล่าวยังไม่ถูกรบกวนโดยส่วนประกอบทางชีวภาพต่างๆในร่างกาย เช่น หนอง เป็นต้น ซึ่งต่างจากยาสังเคราะห์อย่างซัลโฟนาไมด์ การค้นพบยาปฏิชีวนะที่มีประสิทธิภาพสูงนี้ได้กลายเป็นการเปิดประวัติศาสตร์หน้าใหม่แห่งการแพทย์ โดยการค้นพบและพัฒนาเพนิซิลลินขึ้นมาได้จุดกระแสความสนใจใหม่ให้แก่นักวิจัยในการค้นคว้าหาสารประกอบที่มีฤทธิ์ในการต้านแบคทีเรียใหม่ๆที่มีประสิทธิภาพและความปลอดภัยในระดับเดียวกันกับเพนิซิลลินอีกมากมาย[43] โดยความสำเร็จในการคิดค้นพัฒนาเพนิซิลลินในครั้งนี้ ถึงแม้เฟลมมิงจะค้นพบยาดังกล่าวโดยบังเอิญและไม่สามารถพัฒนายาดังกล่าวได้ด้วยตนเอง ทำให้เขาได้รับรางวัลโนเบลในปี ค.ศ. 1945 ร่วมกับเอินซต์ เชน และฮาเวิร์ด ฟลอเรย์ ในฐานะผู้ค้นพบ และพัฒนาเพนิซิลลินเพื่อใช้ในการรักษาโรคติดเชื้อแบคทีเรียต่างๆได้สำเร็จ[38]
ฟลอเรย์ได้ยกความดีความชอบให้แก่เรเน ดูบูส์ (Rene Dubos) ที่ได้บุกเบิกคิดค้นวิธีการในการค้นหาสารประกอบที่มีฤทธิ์ต้านแบคทีเรียไว้อย่างดีและเป็นระบบ จนทำให้ดูบูส์ค้นพบกรามิซิดิน และทำให้งานวิจัยเกี่ยวกับเพนิซิลลินของฟลอเรย์เกิดขึ้นมาได้[44] โดยในปี ค.ศ. 1939 ซึ่งเป็นช่วงเวลาที่ใกล้เกิดสงครามโลกครั้งที่ 2 ดูบูส์ได้ค้นพบสารที่มีฤทธิ์ต้านแบคทีเรียชนิดแรกที่ได้จากธรรมชาติ คือ ไทโรธริซิน ซึ่งเป็นสารที่เป็นส่วนผสมของกรามิซิดิน ร้อยละ 20 และไทโรซิดีน ร้อยละ 80 โดยสกัดสารดังกล่าวได้จากแบคทีเรีย Brevibacillus brevis โดยสารดังกล่าวถือเป็นยาปฏิชีวนะชนิดแรกที่ถูกผลิตออกมาในเชิงการค้า และมีประสิทธิดีเป็นอย่างมากในการรักษาแผลและแผลเปื่อย (ulcer) ในช่วงสงครามโลกครั้งที่ 2[44] อย่างไรก็ตาม กรามิซิดินไม่สามารถบริหารยาโดยการให้ทางระบบได้ เนื่องจากยาดังกล่าวก่อให้เกิดพิษแก่ร่างกาย เช่นเดียวกันกับไทโรซิดีนที่มีความเป็นพิษเป็นอย่างมากเมื่อเทียบกับกรามิซิดิน ทั้งนี้ ผลการศึกษาวิจัยต่างๆที่เกิดขึ้นในช่วงสงครามโลกครั้งที่ 2 นี้ไม่ได้ถูกแบ่งกันระหว่างฝ่ายสัมพันธมิตรกับฝ่ายอักษะ และมีการเข้าถึงอย่างจำกัดในช่วงสงครามเย็น ทำให้การต่อยอดหรือพัฒนางานวิจัยต่างๆนั้นมีความก้าวหน้าช้ากว่าที่ควร[45]
การสังเคราะห์ยาปฏิชีวนะจากสีย้อม
ยาปฏิชีวนะสังเคราะห์เป็นวิทยาศาตร์ที่พัฒนาขึ้นแรกเริ่มในเยอรมนีในปีทศวรรษที่ 1880 โดยเพาล์ เอร์ลิช – แพทย์และนักวิทยาศาสตร์ชาวเยอรมัน[15] เอร์ลิชพบว่าสีย้อมบางชนิดสามารถทำให้เซลล์สัตว์, มนุษย์ หรือแบคทีเรียติดสีได้ ขณะที่เซลล์สิงมีชีวิตอื่นไม่ติดสีดังกล่าว จากนั้นเขาจึงมีความคิดว่ามีความเป็นไปได้ที่จะใช้สารเคมีบางอย่างที่จำเพาะต่อเซลล์หนึ่งๆมาเป็นยาที่ใช้ฆ่าแบคทีเรียก่อโรคได้โดยไม่ก่อให้เกิดอันตรายแก่มนุษย์ หลังจากนั้นเขาได้ทำการศึกษาสีย้อมที่มีฤทธิ์ต้านจุลชีพหลายร้อยชนิด จนในที่สุด เขาก็ได้พบสารที่มีฤทธิ์ต้านแบคทีเรียที่มีชื่อว่า ซาลวาซาน ในปี ค.ศ. 1907[15][46][47] ซึ่งปัจจุบันรู้จักกันในชื่อ อาร์สเฟนามิน[48][49]

ยุคของการรักษาด้วยยาปฏิชีวนะนั้นเริ่มต้นขึ้นเมื่อมีการค้นพบยาปฏิชีวนะสังเคราะห์ที่เป็นอนุพันธ์ของสารหนูโดยอัลเฟรด เบอร์ธม (Alfred Bertheim) และเอร์ลิช เมื่อปี ค.ศ. 1907[50][51] เอร์ลิชและเบอร์ธมได้ศึกษาทดลองรักษาโรคทริปาโนโซมิเอซิสในหนูไมซ์ และการติดเชื้อแบคทีเรียสกุลสไปโรคีทในกระต่ายด้วยสารเคมีจากสีย้อมหลายชนิด การทดลองในช่วงแรกนั้นประสบความล้มเหลวเนื่องจากสีย้อมเหล่านั้นก่อให้เกิดพิษต่อสัตว์ทดลองมากเกินไป ต่อมาเพาล์ เอร์ลิชได้ทำการศึกษาเพื่อค้นหายาปฏิชีวนะในการรักษาซิฟิลิสตามคำร้องขอของกองทัพในขณะนั้น โดยทำการศึกษาร่วมกับซาฮาชิโร ฮาตะ–นักจุลชีววิทยาชาวญี่ปุ่น จนค้นพบสารที่มีคุณสมบัติตามต้องการจากบรรดาสารเคมีที่ทำการศึกษาทั้งหมด 606 ชนิด ใน ค.ศ. 1910 เอร์ลิช และฮาตะได้เผยแพร่การค้นพบที่สำคัญครั้งนี้สู่สาธารณะ ณ งานการประชุมอายุรศาสตร์ที่เมืองวีสบาเดิน โดยทั้งสองได้ตั้งชื่อยาดังกล่าวว่า 606[49] จากนั้นบริษัทฮุชต์ (Hoechst) ได้เริ่มทำการผลิตยาดังกล่าวออกสู่ตลาดยาในช่วงปลายทศวรรษที่ 1910 ภายใต้ชื่อการค้า Salvarsan ในปัจจุบันยานี้เป็นที่รู้จักกันในชื่อ อาร์สเฟนามิน[49] โดยถูกนำมาใช้เป็นยารักษาซิฟิลิสในช่วงต้นคริสต์ศตวรรษที่ 20 จากการค้นพบอาร์สเฟนามินนี้ ทำให้เอร์ลิชได้รับรางวัลโนเบลสาขาสรีรวิทยาและการแพทย์ในปี ค.ศ. 1908 จากการศึกษาค้นคว้าด้านระบบภูมิคุ้มกัน[52] ส่วนซาฮาชิโร ฮาตะได้รับการเสนอชื่อให้เข้ารับรางวัลโนเบลสาขาเคมีในปี ค.ศ. 1911 และสาขาสรีรวิทยาหรือการแพทย์ในปี ค.ศ. 1912 และ 1913[53]
ยาซัลโฟนาไมด์ชนิดแรกของกลุ่มยานี้อย่าง พรอนโตซิล ถือเป็นยาปฏิชีวนะสังเคราะห์ชนิดแรกที่อยู่ในรูปแบบที่พร้อมออกฤทธิ์ได้ โดยยาดังกล่าวถูกพัฒนาขึ้นในช่วงปี ค.ศ. 1932–1933 โดยทีมนักวิจัยที่นำทีมโดย แกร์ฮาร์ด โดมักค์ ณ ห้องปฏิบัติการของบริษัทไบเออร์ ซึ่งเป็นบริษัทในเครือของกลุ่มบริษัทไอ.จี.ฟาร์เบินในประเทศเยอรมนี[51][54][47] การค้นพบนี้ทำให้โดมักค์ได้รับรางวัลโนเบลสาขาสรีรวิทยาหรือการแพทย์ในปี ค.ศ. 1939[55] ส่วนซัลฟานิลาไมด์ซึ่งเป็นรูปแบบที่ออกฤทธิ์ของพรอนโตซิลนั้นไม่ได้รับอนุญาตให้จดสิทธิบัตร เนื่องจากสารดังกล่าวนั้นถูกใช้ในอุตสาหกรรมสีย้อมก่อนหน้ามาเป็นเวลาหลายปีแล้ว[54] พรอนโตซิลเป็นยาปฏิชีวนะที่มีขอบเขตการออกฤทธิ์ค่อนข้างกว้าง โดยมีฤทธิ์ต้านแบคทีเรียแกรมบวกทรงกลม (cocci) ได้ดี แต่ไม่มีฤทธิ์ต่อวงศ์เอนเทอร์โรแบคทีเรียซีอี การค้นพบพรอนโตซิลนี้เป็นการเปิดศักราชใหม่ของการแพทย์ที่ส่งผลเกิดการตื่นตัวในการคิดค้นพัฒนายาปฏิชีวนะอื่นตามมาเป็นอย่างมาก[56][57]
กลไกการออกฤทธิ์

เนื่องจากการออกฤทธิ์ของยาปฏิชีวนะนั้นงส่งผลต่อเซลล์ของแบคทีเรียได้อย่างหลากหลาย กลไกการออกฤทธิ์ของยาปฏิชีวนะแต่ละชนิดนั้นก็ล้วนแต่มีความแตกต่างกันออกไป ทั้งนี้ขึ้นกับชนิดของยาปฏิชีวนะ เชื้อแบคทีเรียเป้าหมาย รวมไปถึงเป้าหมายการออกฤทธิ์ในระดับโมเลกุล อย่างไรก็ตาม เป้าหมายการออกฤทธิ์ในเซลล์แบคทีเรียของยาปฏิชีวนะที่มีใช้ในปัจจุบันนั้นส่วนใหญ่แล้วมักเป็นส่วนประกอบที่ไม่มีในเซลล์ของสัตว์เลี้ยงลูกด้วยนม
ผนังเซลล์
ส่วนนี้รอเพิ่มเติมข้อมูล คุณสามารถช่วยเพิ่มข้อมูลส่วนนี้ได้ |
เยื่อหุ้มเซลล์
ส่วนนี้รอเพิ่มเติมข้อมูล คุณสามารถช่วยเพิ่มข้อมูลส่วนนี้ได้ |
กรดนิวคลีอิกและโปรตีน
ส่วนนี้รอเพิ่มเติมข้อมูล คุณสามารถช่วยเพิ่มข้อมูลส่วนนี้ได้ |
ไรโบโซม
ส่วนนี้รอเพิ่มเติมข้อมูล คุณสามารถช่วยเพิ่มข้อมูลส่วนนี้ได้ |
การใช้ประโยชน์ทางการแพทย์
ยาปฏิชีวนะเป็นยาที่ถูกใช้ในการรักษาและป้องกันการติดเชื้อแบคทีเรีย[2][59] และในบางครั้งถูกใช้เป็นยาต้านโพรโทซัว (เมโทรนิดาโซล สำหรับรักษาโรคที่เกิดจากการติดเชื้อโพรโตซัวบางสายพันธุ์ และในบางครั้งก็อาจถูกนำมาใช้เป็นยาต้านปรสิตได้เช่นกัน เมื่อพบว่ามีการติดเชื้อแบคทีเรียหรือมีอาการที่อาจบ่งบอกได้ว่าเป็นการติดเชื้อแบคทีเรีย แต่ยังไม่สามารถจำแนกสายพันธุ์ของเชื้อก่อโรคได้ จะมีการให้การรักษาด้วยยาปฏิชีวนะที่เรียกว่า การให้ยาปฏิชีวนะแบบครอบคลุมเชื้ออย่างกว้าง (empiric therapy) เพื่อให้ครอบคลุมเชื้อที่อาจเป็นสาเหตุทั้งหมด[60] อย่างไรก็ตาม การให้ยาปฏิชีวนะที่ออกฤทธิ์กว้าง (broad-spectrum antibiotic) จะขึ้นอยู่อาการและอาการแสดงของผู้ป่วยและผลการจรวจทางห้องปฏิบัติการในแต่ละวัน ซึ่งอาจต้องใช้เวลาหลายวันในการระบุเชื้อสาเหตุที่แน่ชัดได้[59][60]
เมื่อทราบถึงสายพันธุ์ของเชื้อก่อโรคดังข้างต้นแล้ว แบบแผนการรักษาด้วยยาปฏิชีวนะจะถูกปรับเปลี่ยนให้จำเพาะเจาะจงกับเชื้อสาเหตุนั้นๆมากขึ้น โดยทั่วไปมักเลือกใช้ยาปฏิชีวนะที่มีขอบเขตการออกฤทธิ์ครอบคลุมเชื้อที่แคบลง (narrow-spectrum antibiotic) ทั้งนี้ การปรับเปลี่ยนแบบแผนการรักษานี้จะขึ้นอยู่กับข้อบ่งใช้ ราคา ประสิทธิภาพ ความปลอดภัย และความสะดวกในการใช้ยานั้น การระบุชนิดของเชื้อก่อโรคที่จำเพาะถือเป็นจุดสำคัญในการรักษา เนื่องจากจะช่วยลดค่าใช้จ่าย รวมไปถึงความเสี่ยงที่อาจเกิดพิษหรืออาการไม่พึงประสงค์ จากการที่ต้องได้รับการรักษายาปฏิชีวนะที่ออกฤทธิ์กว้างหรือหลายชนิดร่วมกัน อีกทั้งยังช่วยลดความเป็นไปได้ที่จะเกิดภาวะเสี่ยงจากการดื้อยาของเชื้อแบคทีเรียได้ด้วย[60] ในอีกกรณีหนึ่ง การมีการใช้ยาปฏิชีวนะในผู้ป่วยที่มีภาวะไส้ติ่งอักเสบเฉียบพลัน เป็นการรักษาอีกหนึ่งทางเลือกโดยไม่ต้องทำการผ่าตัด[61]
นอกจากนี้แล้ว ยังมีการใช้ยาปฏิชีวนะเพื่อเป็นการป้องกัน (prophylactic) เฉพาะในผู้ที่มีความเสี่ยงต่อการติดเชื้อแบคทีเรียสูง เช่น ผู้ที่มีภูมิคุ้มกันบกพร่อง (โดยเฉพาะผู้ป่วยเอดส์ เพื่อป้องกันโรคปอดบวม), ผู้ที่กำลังอยู่ระหว่างการใช้ยากดภูมิคุ้มกัน, ผู้ป่วยมะเร็ง และผู้ป่วยที่ต้องได้รับการผ่าตัด[59] อาจการใช้ยาปฏิชีวนะก่อนและหลังการผ่าตัดเพื่อช่วยป้องกันการติดเชื้อแบคทีเรียบริเวณแผล และมีการใช้ในทางทันตกรรมเพื่อเป็นการป้องกันการติดเชื้อแบคทีเรียในกระแสเลือดและการเกิดภาวะเยื่อบุหัวใจอักเสบติดเชื้อ รวมไปถึงการใช้ยาปฏิชีวนะในการป้องกันการติดเชื้อแบคทีเรียในผู้ป่วยที่มีนิวโตรฟิลในเลือดต่ำ โดยเฉพาะอย่างยิ่ง ในผู้ป่วยมะเร็ง[62][63]
การบริหารยา
การบริหารยาปฏิชีวนะนั้นสามารถกระทำได้หลายช่องทาง โดยปกติแล้วมักใช้การบริหารยาโดยการรับประทานทางปาก แต่ในกรณีที่ผู้ป่วยมีอาการรุนแรง โดยเฉพาะอย่ายิ่ง ในผู้ป่วยที่มีการติดเชื้อในกระแสเลือดอย่างรุนแรง จะบริหารยาให้แก่ผู้ป่วยด้วยวิธีการฉีดเข้าหลอดเลือดดำ หรือการฉีดอื่น[2][60] ในกรณีที่ตำแหน่งที่เกิดการติดเชื้ออยู่ในบริเวณที่ยาปฏิชีวนะสามารถแพร่กระจายเข้าไปได้โดยง่าย อาจบริหารยาปฏิชีวนะนั้นๆได้ด้วยการใช้ในรูปแบบยาใช้ภายนอก อาทิ การใช้ยาหยอดตาหยอดลงเยื่อบุตาในกรณีเยื่อบุตาอักเสบ หรือการใช้ยาหยอดหู ในกรณีติดเชื้อแบคทีเรียในหูหรือหูชั้นนอกอักเสบเฉียบพลัน (acute otitis externa) ยาใช้ภายนอกในรูปแบบยาทาเป็นอีกทางเลือกหนึ่งสำหรับผู้ที่มีการติดเชื้อบริเวณผิวหนังที่ไม่รุนแรง เช่น สิวอักเสบจากการติดเชื้อแบคทีเรีย (acne vulgaris) และเซลล์เนื้อเยื่ออักเสบ (Cellulitis)[64] โดยประโยชน์จากการใช้ยาปฏิชีวนะในรูปแบบยาใช้ภายนอก ได้แก่ บริเวณที่เกิดการติดเชื้อจะมีความเข้มข้นของยาสูงและมีความสม่ำเสมอ, ลดความเสี่ยงที่อาจเกิดพิษหรืออาการไม่ประสงค์บางอย่างจากการใช้ยา, และปริมาณยาที่ต้องใช้ในการรักษาลดลง นอกจากนี้ยังลดปริมาณการใช้ยาปฏิชีวนะในทางที่ผิดได้อีกด้วย[65] นอกจากนี้ การทายาปฏิชีวนะชนิดทาในกรณีแผลผ่าตัดนั้นก็สามารถลดความเสี่ยงในการเกิดการติดเชื้อในแผลผ่าตัดได้[66] อย่างไรก็ตาม ยังมีบางประเด็นที่กังวลเกี่ยวกับการใช้ยาปฏิชีวนะชนิดใช้ภายนอก เนื่องจากอาจมีการดูดซึมยาเข้าสู่กระแสเลือดได้ในบางกรณี, ปริมาณยาที่ใช้ในแต่ละครั้งนั้นยากที่จะกำหนดให้แม่นยำได้ และอาจทำให้เกิดภาวะภูมิไวเกิน หรือผื่นแพ้สัมผัสได้[65]
อาการไม่พึงประสงค์

ยาปฏิชีวนะนั้นจำเป็นต้องมีการศึกษาทดลองเพื่อค้นหาอาการไม่พึงประสงค์ต่างๆของยาที่อาจเกิดขึ้นได้ก่อนจะมีการอนุมัติให้ใช้เพื่อการบำบัดรักษาโรคในมนุษย์ และยาได้รับอนุมัตินั้นต้องมีความปลอดภัยและผู้ป่วยสามารถยอมรับหรือทนต่ออาการข้างเคียงที่อาจเกิดขึ้นได้ อย่างไรก็ตาม ยาปฏิชีวนะบางชนิดนั้นมีความสัมพันธ์กับการเกิดอาการไม่พึงประสงค์หลายอย่าง ตั้งแต่รุนแรงเล้กน้อยไปขนถึงรุนแรงมาก ขึ้นอยู่กับชนิดของยาปฏิชีวนะที่ถูกใช้, จุลชีพเป้าหมาย, และปัจจัยอื่นที่เป็นปัจเจก[67][68] อาการไม่พึงประสงค์จากยานั้นอาจเป็นผลมาจากมาจากคุณสมบัติทางเภสัชวิทยาหรือพิษวิทยาของยานั้นหรือเกิดจากการเหนี่ยวนำให้เกิดภาวะภูมิไวเกิน หรือปฏิกิริยาการแพ้ยา[5] โดยอาการไม่พึงประสงค์ที่เกิดขึ้นอาจมีตั้งแต่ ไข้ หนาวสั่น คลื่นไส้ ไปจนถึงอาการที่รุนแรงอย่างปฏิกิริยาการแพ้ยาได้ เช่น ผื่นแพ้แสงแดด (photodermatitis) และปฏิกิริยาภูมิแพ้เฉียบพลันรุนแรง (Anaphylaxis) [69] ทั้งนี้ ข้อมูลด้านความปลอดภัยของยาใหม่นั้น โดยปกติแล้วมักมีข้อมูลไม่ครอบคลุมอาการไม่พึงประสงค์ที่อาจเกิดขึ้นได้เทียบเท่ากับยาเก่าที่มีการใช้ในมนุษย์มาเป็นเวลานาน[67]
อาการไม่พึงประสงค์จากยาปฏิชีวนะที่เกิดขึ้นได้ทั่วไปในผู้ที่ได้รับการรักษาด้วยยาปฏิชีวนะอย่าง อาการท้องเสียนั้นเป็นผลมาจากการรบกวนสมดุลเชื้อจุลินทรีย์ประจำถิ่นในลำไส้ (intestinal flora) ทำให้เกิดการเจริญเติบโตของเชื้อแบคทีเรียก่อโรคอื่นๆ เช่น Clostridium difficile[70] นอกจากนี้ ยาปฏิชีวนะยังส่งผลต่อสมดุลเชื้อจุลินทรีย์ประจำถิ่นในช่องคลอด (vaginal flora) ได้ด้วย ทำให้เกิดการเพิ่มจำนวนขึ้นของยีสต์สกุลแคนดิดาในช่องคลอดและบริเวณปากช่องคลอดได้[71] ทั้งนี้ อาการไม่พึงประสงค์จากยาปฏิชีวนะอาจเกิดขึ้นได้จากการเกิดอันตรกิริยาระหว่างยา (drug interaction) ระหว่างยาปฏิชีวนะกับยาอื่นได้ เช่น ความเสี่ยงที่อาจเกิดความเสียหายต่อเอ็นกล้ามเนื้อ (tendon) จากการใช้ยาปฏิชีวนะกลุ่มควิโนโลน (quinolone antibiotic) ร่วมกับคอร์ติโคสเตอรอยด์ที่ให้ผ่านทางระบบ[72]
สหสัมพันธ์กับโรคอ้วน
การสัมผัสกับยาปฏิชีวนะในช่วงต้นของชีวิตมีความสัมพันธ์กับการเพิ่มขึ้นของมวลกายในมนุษย์และหนูทดลอง[73] ทั้งนี้ เนื่องมาจากในช่วงตอนต้นของชีวิตนั้นเป็นช่วงที่มีการสร้างสมจุลินทรีย์ประจำถิ่นในลำไส้ และการพัฒนาระบบเมแทบอลิซึมของร่างกาย[74] ในหนูทดลองที่สัมผัสกับยาปฏิชีวนะในระดับที่ต่ำกว่าที่ใช้ในการรักษาโรค (subtherapeutic antibiotic treatment; STAT) ชนิดใดชนืดหนึ่ง ได้แก่ เพนิซิลลิน, แวนโคมัยซิน, หรือ คลอร์เตตราไซคลีน นั้นจะเกิดการรบกวนการสร้างสมจุลินทรีย์ประจำถิ่นในลำไส้ รวมไปถึงความสามารถในการเผาผลาญสารอาหารของร่างกาย (metabolism)[75] มีการศึกษาที่พบว่าหนูไมซ์ (mice) ที่ได้รับยาเพนิซิลลินในขนาดต่ำ (1 ไมโครกรัม/น้ำหนักตัว 1 กรัม) ตั้งแต่แรกเกิดจนถึงช่วงหย่านม มีการเพิ่มขึ้นของมวลร่างกายและมวลไขมัน, มีการเจริญเติบโตที่เร็วมากขึ้น, และมีการเพิ่มการแสดงออกของยีนของตับที่เหนี่ยวนำให้เกิดกระบวนการสร้างเซลล์ไขมัน ในอัตราที่มากกว่าหนูตัวอื่นในกลุ่มควบคุมที่ไม่ได้รับยาปฏิชีวนะ[76] นอกจากนี้ การได้รับเพนิซิลลินร่วมกับอาหารที่มีปริมาณไขมันสูงนั้นมีผลเพิ่มระดับอินซูลินขณะที่ท้องว่างในหนูไมซ์[76] อย่างไรก็ตาม ยังไม่เป็นทราบแน่ชัดว่า โดยแท้จริงแล้วยาปฏิชีวนะเป็นสาเหตุหนึ่งที่ทำให้เกิดโรคอ้วนในมนุษย์ได้หรือไม่ การศุกษาบางการศึกษาพบการมีสหสัมพันธ์ระหว่างการได้รับยาปฏิชีวนะตั้งแต่ในวัยทารก (อายุ <6 เดือน) กับการเพิ่มขึ้นของมวลกาย (ที่อายุ 10 และ 20 เดือน)[77] อีกการศึกษาหนึ่งพบว่า ชนิดของยาปฏิชีวนะที่ได้รับนั้นมีความสัมพันธ์กับการเกิดโรคอ้วน โดยผู้ที่ได้รับยากลุ่มแมโครไลด์ จะมีความเสี่ยงต่อการเกิดภาวะน้ำหนักเกินสูงกว่าผู้ที่ได้รับยาเพนิซิลลินหรือเซฟาโลสปอรินอย่างมีนัยสำคัญ[78] ดังนั้น จึงอาจสรุปได้ว่าการได้รับยาปฏิชีวนะในช่วงวัยทารกนั้นมีความสัมพันธ์กับการเกิดโรคอ้วนในมนุษย์ แต่ความสัมพันธ์เชิงเหตุผลในประเด็นดังกล่าวนั้นยังไม่เป็นที่ทราบแน่ชัด ทั้งนี้ ถึงแม้ว่าจะมีความสัมพันธ์ระหว่างการเกิดโรคอ้วนกับการได้รับยาปฏิชีวนะก็ตาม การใช้ยาปฏิชีวนะในทารกก็ควรที่จะชั่งน้ำหนักถึงความเสี่ยงที่อาจเกิดขึ้นกับประโยชน์ทางคลินิกที่จะได้รับอยู่เฉกเช่นเดิมเสมอ[74]
อันตรกิริยา
ยาเม็ดคุมกำเนิด
การศึกษาทางคลินิกที่มีคุณภาพสูงที่ศึกษาเกี่ยวกับความสัมพันธ์ระหว่างผลของการยาปฏิชีวนะต่อประสิทธิภาพในการคุมกำเนิดของยาเม็ดคุมกำเนิดชนิดรับประทานนั้นยังมีไม่มากนัก[79] การศึกษาหลายการศึกษาให้ผลลัพธ์ที่บ่งชี้ว่ายาปฏิชีวนะไม่มีผลรบกวนการออกฤทธิ์คุมกำเนิดของยาเม็ดคุมกำเนิดชนิดรับประทานแต่อย่างใด[80] นอกจากนี้ การศึกษาเหล่านั้นยังลงความเห็นไว้ว่า อัตราการคุมกำเนิดล้มเหลวในผู้ที่ใช้วิธีการคุมกำเนิดโดยการรับประทานยาเม็ดคุมกำเนิดนั้นอยู่ในสัดส่วนที่ต่ำมาก (ประมาณร้อยละ 1)[81] โดยสภาวะที่อาจเพิ่มความเสี่ยงต่อการคุมกำเนิดด้วยาเม็ดคุมกำเนิดแล้วล้มเหลวนั้นได้แก่ ความร่วมมือในการใช้ยา (ลืมรับประทานยา), อาเจียน หรือท้องเสีย ความผิดปกติของระบบทางเดินอาหาร หรือความแตกต่างของปัจจัยอื่นระดับบุคคลที่ส่งผลต่อการดูดซึมนั้นจะส่งผลต่อระดับความเข้มข้นของฮอร์โมนเอทินิลเอสทราไดออลในกระแสเลือดได้[79] นอกจากนี้ ผู้หญิงที่มีประจำมาไม่ปกติเป็นประจำอาจเพิ่มความเสี่ยงต่อการเกิดความล้มเหลวในการคุมกำเนิดด้วยาคุมกำเนิดชนิดรับประทานได้ และควรได้รับคำแนะนำให้ใช้วิธีการคุมกำเนิดอื่นร่วมด้วยเพิ่มเติมในช่วงเวลาที่จำเป็นต้องใช้ยาปฏิชีวนะเพื่อรักษาโรคและในช่วง 1 สัปดาห์หลังหยุดใช้ยาปฏิชีวนะ หากพบว่าผู้ป่วยมีความเสี่ยงอื่นใดที่ส่งผลลดประสิทธิภาพของยาเม็ดคุมกำเนิดชนิดรับประทาน แนะนำให้ใช้วิธีการคุมกำเนิดอย่างอื่นร่วมด้วย เพื่อลดความเสี่ยงในการตั้งครรภ์[79]
ในกรณที่พบว่ายาปฏิชีวนะมีผลต่อประสิทธิภาพในการคุมกำเนิดของยาเม็ดคุมกำเนิด เช่น ในกรณีของไรแฟมพิซิน ซึ่งเป็นยาปฏิชีวนะนั้นออกฤทธิ์กว้างครอบคลุมเชื้อแบคทีเรียหลายชนิด โดยยานี้จะส่งผลต่อประเด็นดังกล่าวได้เนื่องจากยาจะทำให้เอนไซม์ของตับทำงานมากขึ้น ทำให้มีการกำจัดฮอร์โมนเอทินิลเอสทราไดออล ซึ่งเป็นฮอร์โมนที่ใช้ในการคุมกำเนิด ออกจากร่างกายในอัตราที่มากขึ้น ซึ่งจะส่งผลเพิ่มความเสี่ยงต่อการตั้งครรภ์ได้มากกว่าปกติ[80] นอกจากนี้ ยาปฏิชีวนะดังกล่าวจะทำลายจุลินทรีย์ประจำถิ่นในทางเดินอาหาร ซึ่งทำหน้าที่ในการเปลี่ยนเมตาบอไลต์ของเอทินิลเอสทราไดออลให้อยู่ในรูปที่ถูกดูดซึมกลับเข้าไปในกระแสเลือดได้ใหม่อีกครั้ง การที่จุลินทรีย์ประจำถิ่นในทางเดินอาหารถูกทำลาย จะทำให้การดูดซึมกลับฮอร์โมนคุมกำเนิดลดน้อยลงได้ อย่างไรก็ตาม ในปัจจุบัน ประเด็นที่เกี่ยวเนื่องกับจุลินทรีย์ประจำถิ่นในทางเดินอาหารนี้ยังเป็นที่ถกเถียงกันอยู่ในทางวิชาการและยังไม่สามารถหาข้อสรุปที่แน่ชัดได้[82][83] ดังนั้น บุคลากรทางการแพทย์จึงควรให้คำแนะนำแก่ผู้อยู่ระหว่างการคุมกำเนิดด้วยาเม็ดคุมกำเนิดชนิดรับประทานที่จำเป็นต้องที่ได้รับการรักษาด้วยยาปฏิชีวนะที่อาจส่งผลต่อประสิทธิภาพในการคุมกำเนิดให้ใช้วิธีการคุมกำเนิดอื่นร่วมด้วย เพื่อลดความเสี่ยงในการตั้งครรภ์ไม่พึงประสงค์[80] แต่ในท้ายที่สุดแล้ว ผลของยาปฏิชีวนะต่อประสิทธิภาพในการคุมกำเนิดของยาเม็ดคุมกำเนิดชนิดรับประทานนั้นยังจำเป็นต้องอาศัยข้อมูลจากการศึกษาวิจัยทางคลินิกเพิ่มเติมอีกในอนาคต เพื่อหาข้อสรุปและปัจจัยต่างๆที่มีผลให้แน่ชัดมากขึ้น[79]
เครื่องดื่มแอลกอฮอล์
อันตรกิริยาระหว่างแอลกอฮอล์กับยาปฏิชีวนะนั้นอาจพบเกิดขึ้นได้ในบางกรณี โดยอาจทำให้เกิดอาการไม่พึงประสงค์ในระดับที่เล็กน้อยไปจนถึงระดับที่อันตรายถึงชีวิต หรือในบางครั้งอันตรกิริยานี้อาจส่งผลลดประสิทธิภาพในการรักษาของยาปฏิชีวนะชนิดนั้นๆลงได้[84][85] การบริโภคเครื่องดื่มแอลกอฮอล์ในปริมาณเพียงเล็กน้อยถึงปานกลางนั้นพบว่าไม่มีผลรบกวนการออกฤทธิ์หรือประสิทธิภาพของยาปฏิชีวนะทั่วไป แต่ยาปฏิชีวนะบางกลุ่มนั้น การบริโภคเครื่องดื่มแอลกอฮอล์ร่วมด้วยแม้เพียงในปริมาณเล็กน้อยก็อาจทำให้เกิดอาการไม่พึงประสงค์จากยาได้[86] ทั้งนี้ ความรุนแรงของอาการไม่พึงประสงค์ที่เกิดขึ้นและประสิทธิภาพของยาปฏิชีวนะที่เปลี่ยนแปลงไปจากสาเหตุข้างต้นนั้นจะขึ้นอยู่กับชนิดและรูปแบบของยาปฏิชีวนะที่ได้รับอยู่ในขณะนั้นด้วย[87]
ยาปฏิชีวนะบางชนิดอย่างเมโทรนิดาโซล, ทินิดาโซล, เซฟาแมนโดล, ลาตามอกเซฟ, เซโฟเพอราโซน, เซฟมีนอกซิม, และฟูราโซลิโดน นั้นสามารถทำให้เกิดกลุ่มอาการคล้ายปฏิกิริยาจากยาไดซัลฟิแรม (Disulfiram-like Reaction) ได้หากมีการบริโภคเครื่องดื่มแอลกอฮอล์ร่วมด้วยระหว่างที่ได้รับยาเหล่านี้ โดยแอลกอฮอล์จะถูกเปลี่ยนแปลงในร่างกายได้น้อยลง เนื่องจากยามีผลยับยั้งการทำงานของเอนไซม์ acetaldehyde dehydrogenase ซึ่งทำหน้าที่เปลี่ยนแปลงแอซีทาลดีไฮด์ซึ่งเป็นสารพิษที่ได้จากการเปลี่ยนแปลงแอลกอฮอล์ของร่างกายให้เป็นกรดแอซิติก ซึ่งเป็นรูปสารที่ไม่ก่อให้เกิดอันตรายแก่ร่างกาย และกกรดแอซิติกนี้จะถูกกำจัดออกจากร่างกายต่อไปทางปัสสาวะ โดยกลุ่มอาการคล้ายปฏิกิริยาจากยาไดซัลฟิแรมนี้จะมีอาการสำคัญ คือ คลื่นไส้ อาเจียน หายใจหอบเหนื่อย หน้าแดง ความดันโลหิตเพิ่มขึ้น[86] นอกจากนี้ ดอกซีไซคลีน และอิริโทรมัยซิน ซัคซิเนท อาจมีประสิทธิภาพลดลงได้หากดื่มเครื่องดื่มแอลกอฮอล์ในระหว่างที่ได้รับการรักษาด้วยยาชนิดนี้ [88] ส่วนผลอื่นๆของแอลกอฮอล์ต่อการออกฤทธิ์ของยาปฏิชีวนะนั้นอาจเป็นผลมาจากการที่แอลกอฮอล์รบกวนการทำงานของเอนไซม์ตับ ซึ่งอาจทำให้ยาปฏิชีวนะบางชนิดถูกกำจัดออกจากร่างกายได้มากขึ้นได้[24]
เภสัชพลศาสตร์
ผลลัพธ์ที่ดีจากการได้รับการรักษาด้วยาปฏิชีวนะนั้นขึ้นอยู่กับหลายปัจจัย ได้แก่ ระบบภูมิคุ้มกันของแต่ละคน, ตำแหน่งที่เกิดการติดเชื้อแบคทีเรีย, และคุณสมบัติทางเภสัชพลศาสตร์และเภสัชจลนศาสตร์ของยาปฏิชีวนะที่ใช้ในการรักษา[89] ฤทธิ์ในการฆ่าเชื้อแบคทีเรียของยาปฏิชีวนะนั้นอาจจะขึ้นอยู่กับระยะการเจริญเติบโตของแบคทีเรียก่อโรค และอัตราการเกิดเมแทบอลิซึมภายในเซลล์ของแบคทีเรีย รวมไปถึงความเร็วในการแบ่งตัวของแบคทีเรียชนิดนั้นๆอีกด้วย[90] โดยปัจจัยที่กล่าวมาดังข้างต้นล้วนเป็นผลลัพธ์ที่ได้มาจากการศึกษาทดลองภายในห้องปฏิบัติการและล้วนให้ผลที่สอดคล้องกับการบำบัดรักษาจริงในทางคลินิก[89][91] ทั้งนี้ เนื่องจากการออกฤทธิ์ในการต้านแบคทีเรียของยาปฏิชีวนะนั้นขึ้นอยู่กับความเข้นข้นของยาปฏิชีวนะชนิดนั้นๆ[92] การศึกษานอกร่างกายมนุษย์ ซึ่งทดลองภายในห้องปฏิบัติการ (in vitro) ได้มีการจำแนกประสิทธิภาพในการออกฤทธิ์ต้านแบคทีเรียของยาปฏิชีวนะโดยใช้ ความเข้มข้นของยาต่ำสุดที่สามารถยับยั้งการเจริญเติบโตของเชื้อแบคทีเรีย (minimum inhibitory concentration; MIC) และ ความเข้มข้นยาต่ำสุดที่ฆ่าแบคทีเรียได้ร้อยละ 90 (minimum bactericidal concentration; MBC)[89][93] โดยใช้ค่าดังกล่าว ร่วมกับคุณสมบัติทางเภสัชจลนศาสตร์ของยาปฏิชีวนะชนิดนั้นๆ และคุณลักษณะอื่นทางเภสัชวิทยาในการทำนายประสิทธิภาพและผลลัพธ์การรักษาของยาปฏิชีวนะชนิดใดชนิดหนึ่งในทางคลินิก[94]
การใช้ยาปฏิชีวนะหลายขนาน
ในการรักษาโรคที่เกิดจากการติดเชื้อแบคทีเรียที่รุนแรงบางชนิด เช่น วัณโรค เป็นต้น การรักษาด้วยยาหลายขนาน (การรักษาด้วยยาปฏิชีวนะอย่างน้อย 2 ชนิดขึ้นไป) จะถูกนำมาพิจารณาใช้เพื่อชะลอหรือป้องกันการดื้อต่อยาปฏิชีวนะของเชื้อสาเหตุ ในกรณีที่เป็นการติดเชื้อแบคทีเรียแบบเฉียบพลัน ยาปฏิชีวนะที่เลือกใช้ในการรักษาด้วยยาหลายขนานนี้จะต้องเป็นยาเสริมฤทธิ์ซึ่งกันและกันจะทำให้มีประสิทธิภาพในการรักษามากกว่าการใช้ยาปฏิชีวนะเพียงชนิดเดียว[95][96] เช่น ในกรณีการติดเชื้อ Staphylococcus aureus ที่ดื้อต่อเมทิซิลลินนั้น อาจให้การรักษาด้วยกรดฟูซิดิค และไรแฟมพิซินร่วมกัน[95] ในทางตรงกันข้าม ยาปฏิชีวนะบางชนิดนั้นเมื่อถูกนำมาใช้ร่วมกันอาจแสดงคุณสมบัติต้านฤทธิ์ซึ่งกันและกัน และทำให้ผลลัพธ์และประสิทธิภาพในการรักษานั้นต่ำกว่าการใช้ยาปฏิชีวนะชนิดนั้นเพียงชนิดเดียวได้เช่นกัน[95] เช่น คลอแรมเฟนิคอล และเตตราไซคลีน จะต้านฤทธิ์ของยากลุ่มเพนิซิลลิน และอะมิโนไกลโคไซด์ อย่างไรก็ตาม การเลือกใช้ยาปฏิชีวนะในกรณีนั้นมีความหลากหลายมากขึ้นอยู่กับชนิดของเชื้อสาเหตุและตำแหน่งที่เกิดการติดเชื้อแบคทีเรีย[97] แต่โดยปกติแล้ว ยาปฏิชีวนะที่ออกฤทธิ์ต้านการเจริญเติบโตของแบคทีเรีย (bacteriostatic antibiotic) มักออกฤทธิ์ต้านกันกับยาปฏิชีวนะที่ออกฤทธิ์ฆ่าเชื้อแบคทีเรีย (bactericidal antibiotic)[95][96]
การแบ่งกลุ่มยาปฏิชีวนะ
โดยปกติแล้วการแบ่งกลุ่มยาปฏิชีวนะนั้นจะแบ่งตามกลไกการออกฤทธิ์, โครงสร้างทางเคมี หรือขอบเขตการออกฤทธิ์ โดยมีเป้าหมายการออกฤทธิ์มุ่งไปที่การขัดขวางการทำงานในระดับเซลล์หรือการเจริญเติบโตของแบคทีเรีย[15] ซึ่งเป้าหมายเหล่านั้นอาจเป็นผนังเซลล์ (กลุ่มเพนิซิลลิน และกลุ่มเซฟาโลสปอริน) หรือเยื่อหุ้มเซลล์ (พอลีมิกซิน) หรือรบกวนการทำงานของเอนไซม์ที่จำเป็นของแบคทีเรีย (กลุ่มไรฟามัยซิน, กลุ่มลิปิอาร์มัยซิน, กลุ่มควิโนโลน, และกลุ่มซัลโฟนาไมด์) โดยที่ออกฤทธิ์ที่ตำแหน่งดังข้างต้นนั้นจะมีคุณสมบัติเป็น ยาปฏิชีวนะที่ออกฤทธิ์ฆ่าเชื้อแบคทีเรีย (bactericidal antibiotic) ส่วนยาปฏิชีวนะอื่นที่ออกฤทธิ์ยับยั้งการสังเคราะห์โปรตีนของแบคทีเรีย (กลุ่มแมโครไลด์, กลุ่มลินโคซาไมด์ และเตตราไซคลีน) จะเป็น ยาปฏิชีวนะที่ออกฤทธิ์ยับยั้งการเจริญเติบโตเชื้อแบคทีเรีย (bacteriostatic antibiotic) ยกเว้นกลุ่มอะมิโมไกลโคไซด์ที่ออกฤทธิ์ฆ่าเชื้อแบคทีเรีย[98] นอกเหนือไปจากนี้มักเป็นการแบ่งตามความจำเพาะในการออกฤทะกับเป้าหมาย ยกตัวอย่างเช่น ยาปฏิชีวนะที่มีขอบเขตการออกฤทธิ์แคบ (Narrow-spectrum antibiotics) จะหมายถึงยาปฏิชีวนะที่ออกฤทธิ์จำเพาะต่อแบคทีเรียกลุ่มใดกลุ่มหนึ่ง อาทิ แบคทีเรียแกรมลบ หรือแบคทีเรียแกรมบวก เป็นต้น ในขณะที่ ยาปฏิชีวนะที่มีขอบเขตการออกฤทธิ์กว้าง (Broad-spectrum antibiotics) จะออกฤทธิ์ต่อแบคทีเรียได้หลายกลุ่ม นอกเหนือจากการแบ่งกลุ่มดังข้างต้น ได้มีการคิดค้นพัฒนายาปฏิชีวนะกลุ่มใหม่เพิ่มขึ้นอีกจำนวนหนึ่ง ซึ่งหากย้อนไปในอดีตราว 40 กว่าปีที่แล้วตั้งแต่ที่มีการค้นพบสารประกอบกลุ่มใหม่ที่มีคุณสมบัติในการต้านแบคทีเรีย ก็ไม่ได้มีการค้นพบยาปฏิชีวนะกลุ่มใหม่เพิ่มขึ้นเท่าใดนัก จนกระทั่งในช่วงปลายคริสต์ทศวรรตที่ 2000 และต้นคริสต์ทศวรรตที่ 2010 ได้มีการพัฒนาคิดค้นยาปฏิชีวนะกลุ่มใหม่ขึ้นได้สำเร็จและถูกนำมาใช้ทางคลินิกมากถึง 4 กลุ่ม ได้แก่ กลุ่มไลโปเพปไทด์ (เช่น แดพโตมัยซิน), กลุ่มไกลซิลไซคลีน (เช่น ไทกีไซคลีน), กลุ่มออกซาโซลิไดโอน (เช่น ไลนิโซลิด), และ กลุ่มลิปิอาร์มัยซิน (เช่น ฟิแดกโซมัยซิน)[99][100]
ทั้งนี้ การแบ่งยาปฏิชีวนะตามกลไกการออกฤทธิ์โดยสังเขปแล้วสามารถแบ่งได้ตามตารางต่อไปนี้:
| ชื่อสามัญทางยา | ชื่อการค้า | ข้อบ่งใช้ | อาการไม่พึงประสงค์[101] | กลไกการออกฤทธิ์[101] |
|---|---|---|---|---|
| อะมิโนไกลโคไซด์ | ||||
| อะมิกาซิน[102] | Amikin | การติดเชื้อแบคทีเรียแกรมลบอย่างรุนแรง ได้แก่ Escherichia coli และ Klebsiella. โทบรามัยซิน ออกฤทธิ์ต่อ Pseudomonas aeruginosa ได้ดีมาก. นีโอมัยซิน สามารถใช้เพื่อป้องกันการติดเชื้อแบคทีเรียในผู้ที่ต้องได้รับการผ่าตัดบริเวณช่องท้องได้. ยากลุ่มนี้มีประสิทธิภาพดีในการรักษาโรคที่เกิดจากการติดเชื้อที่เกิดจากเชื้อแบคทีเรียกลุ่มที่ไม่ใช้ออกซิเจน (ยกเว้นสายพันธุ์ที่เจริญได้ทั้งที่มีและไม่มีออกซิเจน; Facultative anaerobe) เนติลมัยซิน สามารถออกฤทธิ์ต่อเชื้อแบคทีเรียที่ดื้อต่อเจนตามัยซินและโทบรามัยซินได้ดี[103] |
|
ยับยั้งการสังเคราะห์โปรตีน โดยจับกับหน่วยย่อย 30 เอสของไรโบโซมแบคทีเรีย ทำให้การแปรรหัสพันธุกรรมผิดพลาด และได้โปรตีนที่ไม่สามารถทำงานได้[104] |
| เจนตามัยซิน | Garamicina | |||
| กานามัยซิน | Kantrex | |||
| นีโอมัยซิน | Neosporin | |||
| เนติลมัยซิน | Netromicina | |||
| สเตรปโตมัยซิน | ||||
| โทบรามัยซิน | Nebcin | |||
| พาโรโมมัยซิน | Humatin | |||
| เอนซามัยซิน | ||||
| เกลดานามัยซิน | ใช้ในการทดลอง: ยาปฏิชีวนะยับยั้งเนื้องอก |
|
เกลดานามัยซินจะออกฤทธิ์ยับยั้งการทำงานของ Hsp90 (Heat Shock Protein 90) โดยจะเข้าจับกับ ADP/ATP-binding pocket ของโปรตีนแปลกปลอม และขัดขวางการวมตัวกันของ Hsp23 ไปเป็น 90/90- Imph Trimer ซึ่งจะส่งผลต่อการก่อตัวของ HER-2 oncogene ส่วนเฮอร์บิมัยซินจะออกฤทธิ์ลดการเกิดปฏิกิริยาฟอสโฟริเลชันของหมู่ไทโรซีนและลดการทำงานของ Cox-2 แบบจำเพาะเจาะจงโดยไม่มีผลต่อ Cox-1.[106] | |
| เฮอร์บิมัยซิน | Herbamicina A | |||
| คาร์บาซีเฟม | ||||
| ลอราคาร์เบฟ | Lorabid | การติดเชื้อแบคทีเรียในระบบหายใจส่วนบนและการติดเชื้อแบคทีเรียในระบบทางเดินปัสสาวะ | ยับยั้งการสังเคราะห์ผนังเซลล์ของแบคทีเรีย | |
| คาร์บาพีแนม | ||||
| เออร์ตาพีแนม | Invanz | ฆ่าได้ทั้งเชื้อแบคทีเรียแกรมบวกและแกรมลบ จึงนิยมใช้สำหรับการให้ยาปฏิชีวนะแบบครอบคลุมเชื้ออย่างกว้าง (empiric therapy) (Staphylococcus aureus ที่ดื้อต่อเมทิซิลลินจะดื้อต่อยากลุ่มนี้ด้วย) การใช้อีมิพีแนมร่วมกับซิลาสเตตินจะช่วยลดการที่อีมิพีแนมถูกทำให้หมดฤทธิ์โดยเอนไซม์ในร่างกายมุนษย์และช่วยลดความเสี่ยงในการเกิดพิษต่อไต ในกลุ่มนี้เออร์ตาพีแนมจะออกฤทธิ์ต้านแบคทีเรียวงศ์เอนเทอร์โรแบคทีเรียซีอีได้ดีที่สุด[108] |
|
ออกฤทธิ์โดยอาศัยวงบีตา-แลคแตม: ยับยั้งการแบ่งตัวของแบคทีเรียโดยการยับยั้งการสร้างผนังเซลล์ของแบคทีเรีย |
| โดริพีแนม | Finibax | |||
| อีมิพีแนม | ||||
| อีมิพีแนม/ซิลาสเตติน | Primaxina | |||
| มีโรพีแนม | Merrem | |||
| เซฟาโลสปอริน (รุ่นที่ 1) | ||||
| เซฟาดรอกซิล | Duricef | เนื่องจากยาทุกชนิดในกลุ่มเซฟาโลสปอรินนี้มีวงบีตา-แลคแตม จึงมีคุณสมบัติเป็นยาปฏิชีวนะที่ออกฤทธิ์ฆ่าเชื้อแบคทีเรีย (Bacteriacidal agents) เช่นเดียวกันกับกลุ่มเพนิซิลลิน โดยจะออกฤทธิ์ต่อแบคทีเรียแกรมบวกได้ดี เช่น สกุลโปรตีอัส, Escherichia coli และสกุลเคลบซิลลา |
|
ออกฤทธิ์เช่นเดียวกับยาอื่นในกลุ่มบีตา-แลคแตม โดยจะรบกวนการสร้างเปบทิโดไกลแคน ซึ่งเป็นส่วนประกอบที่สำคัญของผนังเซลล์ของแบคทีเรีย ยากลุ่มนี้มีความไวต่อเอนไซม์บีตาแลคตาเมสต่ำ |
| เซฟาโซลิน | Ancef | |||
| เซฟาโลติน | Keflin | |||
| เซฟาเลกซิน | Keflex | |||
| เซฟราดีน | Veracef | |||
| เซฟาโลสปอริน (รุ่นที่ 2) | ||||
| เซฟาคลอร์ | Ceclor | มีประสิทธิภาพมากกว่าเพนิซิลลินในการต้านเชื้อแบคทีเรียแกรมลบรูปแท่ง แต่มีประสิทธิภาพเทียบเท่ากันในการต้านแบคทีเรียแกรมบวกรูปวงกลม[109] โดยยากลุ่มนี้จะออกฤทธิ์ครอบคลุมเชื้อต่อไปนี้ได้ดี แบคทีเรียแกรมบวกรูปวงกลม, Haemophilus influenzae, Enterobacter, Neisseria, Proteus, Escherichia coli และ Klebsiella |
|
ออกฤทธิ์เช่นเดียวกับยาอื่นในกลุ่มบีตา-แลคแตม โดยจะรบกวนการสร้างเปบทิโดไกลแคน ซึ่งเป็นส่วนประกอบที่สำคัญของผนังเซลล์ของแบคทีเรีย |
| เซฟาแมนโดล | Mandol | |||
| เซโฟซิติน | Mefoxitin | |||
| เซฟโปรซิล | Cefzil | |||
| เซฟูรอกซิม | Ceftina, Zinnat | |||
| เซฟาโลสปอริน (รุ่นที่ 3) | ||||
| เซฟิซิม | Suprax | เซฟาโลสปอรินกลุ่มนี้จะใช้ในการรักษาโรคติดเชื้อแบคทีเรียยที่รุนแรงอันเนื่องมาจากเชื้อสาเหตุเป็นเชื้อที่ดื้อต่อยาปฏิชีวนะชนิดอื่นในกลุ่มบีตา-แลคแตม เช่น เยื่อหุ้มสมองอักเสบ เป็นต้น ใช้เป็นยาป้องกันการจิดเชื้อแบคทีเรียก่อนการทำศัลยศาสตร์ออร์โทพีดิกส์ หรือการผ่าตัดบริเวณหน้าท้อง หรืออุ้งเชิงกราน |
|
ออกฤทธิ์เช่นเดียวกับยาอื่นในกลุ่มบีตา-แลคแตม โดยจะรบกวนการสร้างเปบทิโดไกลแคน ซึ่งเป็นส่วนประกอบที่สำคัญของผนังเซลล์ของแบคทีเรีย |
| เซฟดิเนียร์ | Omnicef | |||
| เซฟดิตอเรน | Meiact | |||
| เซโฟเพอราโซน | Cefobid | |||
| เซฟโฟแทกซิม | Claforan | |||
| เซฟโปดอกซิม | Vantin | |||
| เซฟตาซิดิม | Fortaz | |||
| เซฟติบูเตน | Cedax | |||
| เซฟติซอกซีม | Cefizox | |||
| เซฟไตรอะโซน | Rocephin | |||
| เซฟาโลสปอริน (รุ่นที่ 4) | ||||
| เซฟีพิม | Maxipime | ออกฤทธิ์ครอบคลุมสกุล Pseudomonas มากขึ้น รวมถึงแบคทีเรียแกรมบวกด้วย |
|
รบกวนการสร้างเปบทิโดไกลแคน |
| เซฟาคลิดีน | Cefclidin | |||
| เซฟาโลสปอริน (รุ่นที่ 5) | ||||
| เซฟโตบิโพรล | Zevtera | มีฤทธิ์ต้าน Staphylococcus aureus ที่ดื้อต่อเมทิซิลลินได้ดี |
|
รบกวนการสร้างเปบทิโดไกลแคน |
| ไกลโคเปปไทด์ | ||||
| ไทโคพลานิน | Targocid | ใช้สำหรับผู้ป่วยในระยะวิกฤติที่แพ้ต่อยากลุ่มบีตา-แลคแตม | เป็นอาการข้างเคียงที่ผันกลับมาเป็นปกติได้:
|
|
| แวนโคมัยซิน | Vancocin | |||
| แมโครไลด์ | ||||
| อะซิโทรมัยซิน | Zitromax, Sumamed, Zitrocin | การติดเชื้อแบคทีเรียสกุลสเตรปโตคอกคัส, ซิฟิลิส, การติดเชื้อแบคทีเรียในระบบทางเดินหายใจ, การติดเชื้อแบคทีเรียสกุลไมโคพลาสมา, โรคไลม์ | ยับยั้งการสังเคราะห์โปรตีนของแบคทีเรีย โดยจับกับหน่วยย่อย 50 เอสของไรโบโซมแบคทีเรีย | |
| คลาริโทรมัยซิน | Klaricid | |||
| ดิริโทรมัยซิน | Dynabac | |||
| อิริโทรมัยซิน | Eritocina, Eritroped | |||
| ร็อกซิโทรมัยซิน | Roxitrol | |||
| โทรลีแอนโดมัยซิน | (TAO) | |||
| เทลิโทรมัยซิน | Ketek | ปอดบวม | การมองเห็นผิดปกติ, เกิดพิษต่อตับ[110] | |
| สเปคติโนมัยซิน | Trobicin | Antimetabolite, มะเร็ง และหนองใน[111] | ||
| มอนอแบคแตม | ||||
| แอซทรีโอแนม | Azactam | การติดเชื้อแบคทีเรียแกรมลบชนิดใช้ออกซิเจน เช่น วงศ์เอนเทอร์โรแบคทีเรียซีอี และสกุลเยอซิเนีย, สกุลเพลสสิโอโมแนส, สกุลแอโรโมแนส, และสกุลไนซีเรีย[112] ไม่มีผลต่อแบคทีเรียแกรมบวกรูปทรงกลม, แบคทีเรียที่ไม่ใช้ออกซิเจน และสกุลอซีเนโตแบคเตอร์[108] | ผื่น, ผลการตรวจการตรวจการทำงานของตับผิดปกติ. สามารถใช้ยานี้ได้อย่างปลอดภัยในผู้ที่แพ้เพนิซิลลิน[108] | เช่นเดียวกันกับยาอื่นในกลุ่มบีตา-แลคแตม: ยับยั้งการสร้างเปบทิโดไกลแคนของแบคทีเรีย ซึ่งเป็นส่วนประกอบที่สำคัญของผนังเซลล์, จับกับเอนไซม์ Penicillin-binding protein 3 (PBP3) ในแบคทีเรียแกรมลบ[108] |
| เพนิซิลลิน | ||||
| อะม็อกซีซิลลิน | Novamox, Amoxil | ใช้รักษาโณคที่เกิดจากการติดเชื้อได้อย่างหลากหลายขึ้นกับชนิดของยา เช่น การติดเชื้อแบคทีเรียสกุลสเตรปโตคอกคัส, ซิฟิลิส, โรคไลม์ |
|
ช่นเดียวกันกับยาอื่นในกลุ่มบีตา-แลคแตม: ยับยั้งการสร้างเปบทิโดไกลแคนของแบคทีเรีย ซึ่งเป็นส่วนประกอบที่สำคัญของผนังเซลล์ |
| แอมพิซิลลิน | Unasayn | |||
| อะโซลซิลลิน | Securopen | |||
| คาร์เบนิซิลลิน | Pyopen | |||
| คลอกซาซิลลิน | Anaclosil | |||
| ไดคลอกซาซิลลิน | Dicloran | |||
| ฟลูคลอกซาซิลลิน | Floxapen | |||
| เมซโลซิลลิน | Baypen | |||
| เมทิซิลลิน | Staphcillin | |||
| นาฟซิลลิน | Nallpen | |||
| ออกซาซิลลิน | Prostafilina | |||
| เบนซิลเพนิซิลลิน (G) | ||||
| ปิปเปอราซิลลิน | Pipracil | |||
| ไทคาร์ซิลลิน | Timentin | |||
| พอลิเพปไทด์ | ||||
| แบซิทราซิน | การติดเชื้อแบคทีเรียที่ตา, หู, กระเพาะปัสสาวะ โดยปกติมักบริหารยาโดยการทาหรือหยอดลงบนบริเวณที่ติดเชื้อโดยตรง พบเห็นการบริหารยาโดยการฉีดได้น้อยมาก | เกิดพิษต่อไตและระบบประสาท หากบริหารยาโดยการฉีด | ยับยั้งการสร้างเปบทิโดไกลแคนของแบคทีเรีย ซึ่งเป็นส่วนประกอบที่สำคัญของผนังเซลล์[113] | |
| โคลิสติน | รบกวนการผ่านเข้าออกของสารต่างๆ (permeability) ของเซลล์แบคทีเรีย โดยเข้าจับกับเยื่อหุ้มเซลล์ของแบคทีเรีย | |||
| พอลีมิกซิน บี | ||||
| ควิโนโลน | ||||
| ซิโปรฟลอกซาซิน | Cipro, Ciproxin, Ciprobay | การติดเชื้อแบคทีเรียในระบบทางเดินปัสสาวะ, ต่อมลูกหมากอักเสบจากการติดเชื้อแบคทีเรีย, โรคปอดอักเสบชุมชน, ท้องเสียจากการติดเชื้อแบคทีเรีย, การติดเชื้อสกุลไมโคพลาสมา, และหนองใน ยากลุ่มนี้มีผลต่อแบคทีเรียที่ไม่ใช้ออกซิเจนน้อยมาก[108] | คลื่นไส้ (น้อยมาก), เส้นเอ็นอักเสบเรื้อรัง (น้อยมาก)[108] | ยับยั้งเอนไซม์ Topoisomerase, DNA gyrase และเอนไซม์อื่นอีกหลายชนิด, ยับยั้งการถ่ายแบบดีเอ็นเอและการถอดรหัสพันธุกรรม |
| อีนอกซาซิน | Enoxin | |||
| กาติฟลอกซาซิน | Tequin | |||
| ลีโวฟลอกซาซิน | Tavanic | |||
| โลมิฟลอกซาซิน | Loflox | |||
| มอกซิฟลอกซาซิน | Avelox | |||
| นอร์ฟลอกซาซิน | Noroxin | |||
| ออฟลอกซาซิน | Ocuflox | |||
| โทรวาฟลอกซาซิน | Trovan | |||
| ซัลโฟนาไมด์ | ||||
| เมฟีไนด์ | การติดเชื้อแบคทีเรียในระบบทางเดินปัสสาวะ (ยกเว้นซัลฟาซีตาไมด์ และเมฟีไนด์) ; เมฟีไนด์ใช้เป็นยาทาแผลไฟไหม้ |
|
ยับยั้งการสังเคราะห์กรดโฟลิก ซึ่งเป็นสารที่มีความสำคัญต่อการสังเคราะห์ดีเอ็นเอและอาร์เอ็นเอ | |
| พรอนโตซิล (ยาเก่า) | ||||
| ซัลฟาซีตาไมด์ | ||||
| ซัลฟาเมไทโซล | ||||
| ซัลฟานิลาไมด์ (ยาเก่า) | ||||
| ซัลฟาซาลาซีน | ||||
| ซัลฟาฟูราโซล | ||||
| ไตรเมโทพริม | ||||
| ไตรเมโทพริม/ซัลฟาเมโทซาโซล (โคไตรมอกซาโซล หรือ แบคตริม) | ||||
| เตตราไซคลีน | ||||
| เดเมโคลไซคลีน | ซิฟิลิส หรือการติดเชื้อแบคทีเรียที่มีสาเหตุมาจากแบคทีเรียสกุลคลามัยเดีย, สกุลไมโคพลาสมา และสกุลสกุลริคเค็ทเซีย รวมไปถึงสิวที่เกิดจากการติดเชื้อแบคทีเรีย | ยับยั้งการสังเคราะห์โปรตีนของแบคทีเรียโดยการเข้าจับกับหน่วยย่อย 30 เอสของไรโบโซมแบคทีเรีย[114] | ||
| ดอกซีไซคลีน | Vibramicina | |||
| มิโนไซคลีน | Minocin | |||
| ออกซิเตตราไซคลีน | Terramicina | |||
| เตตราไซคลีน | Sumycin | |||
| เอมเฟนิคอล | ||||
| คลอแรมเฟนิคอล | Chloromycetin | มีประสิทธิภาพในการต้านแบคทีเรียทั้งแกรมบวกและแกรมลบ รวมไปถึงพวกที่ไม่ใช้ออกซิเจน | การเกิดพิษองยาจะสัมพันธ์กับขนาดยา โดยอาจเกิดการกดไขกระดูก นำไปสู่การเกิดโรคโลหิตจางจากไขกระดูกฝ่อได้ [115]แต่ส่วนใหญ่สามารถผันกลับเป็นปรกติได้หลังการหยุดใช้ยา | เข้าจับกับหน่วยย่อย 50 เอสของไรโบโซมแบคทีเรียแบบผันกลับได้ ส่งผลให้การสังเคราะห์โปรตีนของแบคทีเรียหยุดชะงักและสิ้นสุดลงเร็วกว่าปกติ[103] |
| อื่นๆ | ||||
| อาร์สเฟนามิน | Salvarsan | การติดเชื้อแบคทีเรียชั้นสไปโรคีท (เลิกใช้แล้ว) | เกิดพิษจากสารหนู | ปลดปล่อยอนุภาค RAs (OH)2, ออกมา ซึ่งอนุภาคนี้จะก่อให้เกิดพิษต่อแบคทีเรีย Treponema pallidum |
| คลินดามัยซิน | Cleocin | การติดเชื้อเชื้อแบคทีเรียที่ไม่ใช้ออกซิเจน, สิวจากการติดเชื้อแบคทีเรีย, ใช้ป้องกันการติดเชื้อแบคทีเรียของงแผนก่อนทำการผ่าตัด, และใช้กรณีติดเชื้อแบคทีเรีย Staphylococcus aureus ที่ดื้อต่อเมทิซิลลิน (MRSA)[116] | มักพบการเกิดอาการท้องเสียจากการติดเชื้อแบคทีเรีย Clostridium difficile ซึ่งมักนำไปสู่การเกิดภาวะลำไส้ใหญ่อักเสบ Pseudomembranous colitis (PMC)[117] | ยับยั้งการสังเคราะห์โปรตีนของแบคทีเรีย โดยเข้าจับกับหน่วยย่อย 50 เอสของไรโบโซมแบคทีเรีย[118] |
| ลินโคมัยซิน | Lincocin | สิวอักเสบจากการติดเชื้อแบคทีเรีย, ป้องกันการติดเชื้อแบคทีเรียของแผลหลังการผ่าตัด, โรคที่เกิดจากการติดเชื้อแบคทีเรียในไฟลัมแอคติโนมัยสีท, สกุลไมโคพลาสมา และสกุลพลาสโมเดียมบางสายพันธุ์ | ลำไส้ใหญ่อักเสบ ซึ่งในบางรายอาการอาจรุนแรงจนเสียชีวิตได้ | เช่นเดียวกับกลุ่มแมโครไลด์ โดยจะเข้าจับกับหน่วยย่อย 50 เอสของไรโบโซมแบคทีเรีย เพื่อยับยั้งการสังเคราะห์โปรตีน |
| อีแทมบูทอล | Myambutol (ตัวย่อ: EMB) | ยาต้านวัณโรค[119] | ส่วนใหญ่มักเกิดภาวะเส้นประสาทตาอักเสบ[120] ดังนั้นจึงห้ามใช้ในเด็กอายุต่ำกว่า 6 ปี | ยับยั้งการสร้างผนังเซลล์ของแบคทีเรีย |
| ฟอสโฟมัยซิน | Monurol | การติดเชื้อแบคทีเรียในระบบทางเดินปัสสาวะ | อาการไม่พึงประสงค์น้อย ในบางรายอาจมีอาการคลื่นไส้, อาเจียน | ยับยั้งการสร้างผนังเซลล์ของแบคทีเรีย |
| กรดฟูซิดิค | Fucidin | โดยส่วนใหญ่จะออกฤทธิ์ต่อแบคทีเรียแกรมบวก เช่น สกุลสแตฟฟิโลคอคคัส, สกุลสเตรปโตคอกคัส และสกุลโครีนีแบคทีเรียม | ดีซ่าน, ปัสสาวะสีน้ำตาลคล้ำ ทั้งนี้อาการผิดปกติดังกล่าวสามารถกลับคืนเป็นปกติได้หลังจากหยุดใช้ยา | ยับยั้งการสังเคราะห์โปรตีน โดยขัดขวางกระบวนการการนำสารตัวกลางที่ใช้ในการต่อลำดับกรดอะมิโนกลับมาใช้ใหม่ (Elongation factor) |
| ฟูราโซลิโดน | Furoxone | ท้องเสีย และลำไส้เล็กอักเสบที่มีสาเหตุมาจากการติดเชื้อโปรโทซัว, อหิวาตกโรค และเจียอาร์ไดอาซิส | อาการไม่พึงประสงค์ที่พบได้บ่อยคือ สั่น, ไม่สบายท้อง, คลื่นไส้, อาเจียน, เส้นประสาทอักเสบ (neuritis) | สร้างการเชื่อมโยงข้าม (cross-link) กับดีเอ็นเอของแบคทีเรีย |
| ไอโซไนอะซิด | Laniazid | ยารักษาวัณโรค | ชาตามมือ-เท้า, ตับอักเสบ, คลื่นไส้, อาเจียน, ผื่น | ยับยั้งการสังเคราะห์โปรตีนของเชื้อแบคทีเรีย |
| ไลนิโซลิด | Zyvoxid | การติดเชื้อที่มีสาเหตุมาจากแบคทีเรียแกรมบวกที่ดื้อต่อยาปฏิชีวนะชนิดอื่น | ปวดศีรษะ, คลื่นไส้, อาเจียน, ท้องผูก, ปฏิกิริยาการแพ้ยา, ตับอ่อนอักเสบ, และมีการเพิ่มขึ้นของเอนไซม์ทรานซามิเนส โดยความเสี่ยงในการเกิดอาการไม่พึงประสงค์จะเพิ่มมากขึ้นเมื่อใช้ยาในขนาดสูงหรือต่อเนื่องนานเกินไป | ยับยั้งการสังเคราะห์โปรตีนของแบคทีเรีย โดยเข้าจับกับไรโบโซม |
| เมโทรนิดาโซล | Flagyl หรือ Flegyl | โรคที่เกิดจากการติดเชื้อโปรโทซัว และเชื้อแบคทีเรียที่ไม่ใช้ออกซิเจน ซึ่งรวมถึง Bacteroides fragilis, สกุลฟูโซแบคทีเรียม, สกุลเวอิลโลเนลลา, Clostridium difficile และ C. perfringens, สกุลยูแบคทีเรียม, สกุลเพพโทคอคคัส, สกุลไกอาร์เดีย และสกุลเปปโตสเตรปโตคอกคัส | ปัสสาวะสีแดง, การรับรสผิดปกติ, การใช้ยาต่อเนื่องเป็นระยะเวลานานอาจทำให้เกิดปลายประสาทอักเสบได้[103] | ยับยั้งการสังเคราะห์กรดนิวคลีอิกของแบคทีเรีย โดยทำให้เกิดการแตกออกของดีเอ็นเอ [121][122][123] |
| มูพิโรซิน | Bactroban | ออกฤทธิ์กว้าง โดยที่ความเข้มข้นต่ำจะออกฤทธิ์ต้านการเจริญเติบโตของเชื้อแบคทีเรีย แต่จะออกฤทธิ์ฆ่าเชื้อแบคทีเรียเมื่อมีความเข้มข้นสูง | แบคทีเรียดื้อต่อยานี้ได้ง่าย | ยับยั้งการสังเคราะห์โปรตีนของแบคทีเรีย |
| ไนโตรฟูรานโทอิน | Macrodantina, Macrobido | โดยทั่วไปใช้สำหรับรักษาการติดเชื้อแบคทีเรียในระบบทางเดินปัสสาวะ | ส่วนใหญ่มักมีอาการคลื่นไส้, อาเจียน พบการเกิดอาการทางระบบหายใจที่เกี่ยวเนื่องกับการแพ้ยาได้บ้างเล็กน้อย[124], เกิดพิษต่อระบบทางเดินหายใจ[125][126] | สร้างความเสียหายแก่ดีเอ็นเอ โดยเฉพาะในรูปที่ถูกรีดิวซ์จะออกฤทธิ์ได้ดี[124][127] |
| พลาเทนซิมัยซิน | อยู่ในระหว่างการศึกษาทางคลินิก ซึ่งพบว่าออกฤทธิ์ต้านแบคทีเรีย Staphylococcus aureus ที่ดื้อต่อเมทิซิลลิน (MRSA) ในหนูทดลองได้ดี[128] | ยังไม่ทราบแน่ชัด เนื่องจากกำลังอยู่ในขั้นการศึกษาทางคลินิก | ยับยั้งเอนไซม์ beta-ketoacyl synthases I/II (FabF/B) ซึ่งเป็นเอนไซม์หลักที่ทำหน้าเกี่ยวกับการสังเคราะห์กรดไขมันที่เป็นส่วนประกอบของเยื่อหุ้มเซลล์ของแบคทีเรีย[129] | |
| ไพราซินาไมด์ | ตัวย่อ: PZA | ยารักษาวัณโรค[130] | ปวดตามข้อ แต่ส่วนใหญ่อาการมักไม่รุนแรง,[131][132] ตับอักเสบ[133], คลื่นไส้, อาเจียน, เบื่ออาหาร, ผื่น[130] | ยับยั้งเอนไซม์ Fatty acid synthase (FAS) ซึ่งทำหน้าที่ในการสังเคราะห์กรดไขมันที่เป็นส่วนประกอบของเยื่อหุ้มเซลล์แบคทีเรีย[134] |
| ควินูปริสติน/ดาลโฟปริสติน | Synercid | สกุลสแตฟฟิโลคอคคัส และ Enterococcus faecium ที่ดื้อต่อยาแวนโคมัยซิน[135][136] | ปวดในข้อ, คลื่นไส้, อาเจียน, ท้องเสีย, ผื่น, คัน, ปวดศีรษะ,หลอดเลือดดำอักเสบ, ภาวะบิลิรูบินในเลือดสูง[137] นอกจากนี้ยังส่งผลยับยั้งการทำงานของระบบเอนไซม์ไซโทโครม P450 (CYP 450)[135] | ยับยั้งการสังเคราะห์โปรตีนของแบคทีเรีย โดยยาทั้งสองจะเสริมฤทธิ์กัน[138] ดาลโฟปริสติน จะเข้าจับกับยูนิตย่อย 23 เอสของหน่วยย่อย 50 เอสบนไรโบโซมของแบคทีเรีย ส่งผลให้รูปร่างของไรโบโซมเปลี่ยนไป และช่วยให้ควินูปริสตินเข้าจับกับหน่วยย่อย 50 เอสบนไรโบโซมได้มากขึ้น ซึ่งจะยับยั้งการต่อสายพอลิเปปไทด์[138] |
| ไรแฟมพิซิน หรือ ไรแฟมพิน | Rifaldin | รักษาโรคเรื้อน, วัณโรค และโรคลีเจียนเนลโลสิส โดยใช้ร่วมกับยาปฏิชีวนะอื่น ยกเว้นในกรณีเพื่อป้องกันการติดเชื้อ Haemophilus influenzae ชนิด บี และไข้กาฬหลังแอ่น ในผู้ที่มีความเสี่ยงต่อโรคดังกล่าว[139] | คลื่นไส้, อาเจียน, ท้องเสีย หรือ ไม่อยากอาหาร น้ำปัสสาวะและเหงื่อเป็นสีแดงออกส้ม ตับอักเสบ และยังอาจก่อให้เกิดการแพ้ยาได้[139] | ขัดขวางการสร้างอาร์เอ็นเอของแบคทีเรีย[139] ผ่านการยับยั้งการทำงานของเอนไซม์ DNA-dependent RNA polymerase ของแบคทีเรีย[140] |
| ทินิดาโซล | Fasigyn, Simplotan, Tindamax | ท่อปัสสาวะอักเสบ, ภาวะช่องคลอดอักเสบ, บิดมีตัว และเจียอาร์ไดอาซิส[141][142] | ง่วงซึม, ปวดศีรษะ, มึนงง หากรับประทานพร้อมเครื่องดื่มแอลกอฮอล์จะทำให้เกิดกลุ่มอาการคล้ายปฏิกิริยาจากยาไดซัลฟิแรม (Disulfiram-like Reaction) ได้ เช่น คลื่นไส้ อาเจียน ปวดศีรษะ ความดันโลหิตสูงขึ้น หน้าแดง หายใจหอบเหนื่อย เป็นต้น[141] | ปลดปล่อยอนุมูลอิสระที่เป็นพิษต่อเซลล์ปรสิต[141] |
| ชื่อสามัญทางยา | ชื่อการค้า | ข้อบ่งใช้ | อาการไม่พึงประสงค์[101] | กลไกการออกฤทธิ์[101] |
การผลิต
ด้วยความก้าวหน้าทางเภสัชเคมี ทำให้ยาปฏิชีวนะที่มีใช้อยู่ทุกวันนี้สามารถผลิตได้จากวิธีการกึ่งสังเคราะห์ โดยการดัดแปลงสูตรโครงสร้างของสารประกอบจากธรรมชาติที่มีฤทธิ์ต้านแบคทีเรียให้มีความเหมาะสมในการใช้กับมนุษย์มากขึ้น[143] ตัวอย่างที่เห็นได้อย่างชัดเจนคือ ยาปฏิชีวนะจำพวกบีตา-แลคแตม ซึ่งกลุ่มเพนิซิลลิน (ผลิตจากราในสกุลเพนิซิลเลียม), กลุ่มเซฟาโลสปอริน, และกลุ่มคาร์บาพีแนม ก็ล้วนแต่ถูกจัดอยู่ในยาปฏิชีวนะจำพวกนี้ ส่วนยาปฏิชีวนะที่ใช้ในปัจจุบันที่ต้องสกัดจากจุลชีพที่มีชีวิตเท่านั้น คือ ยาปฏิชีวนะในกลุ่มอะมิโนไกลโคไซด์ ส่วนกลุ่มอื่นๆนั้นล้วนได้มาจากการสังเคราะห์ในห้องปฏิบัติการ เช่น ซัลโฟนาไมด์, ควิโนโลน, ออกซาโซลิไดโอน เป็นต้น[143] ยาปฏิชีวนะโดยส่วนใหญ่มักมีขนาดโมเลกุลที่ค่อนข้างเล็กและมีมวลโมเลกุลน้อยกว่า 1000 ดาลตัน[144]
การที่เอินซต์ เชนและฮาเวิร์ด ฟลอเรย์สามารถสกัดเพนิซิลลินบริสุทธิ์เพื่อใช้ในมนุษย์ได้สำเร็จใน ค.ศ. 1941[145] ทำให้ยาดังกล่าวถูกผลิตขึ้นให้กับกองทัพเพื่อใช้รักษาผู้บาดเจ็บฝ่ายสัมพันธมิตรในระหว่างการทำสงครามโลกครั้งที่ 2 เป็นจำนวนมาก จนทำให้การผลิตที่ประเทศอังกฤษนั้นไม่สามารถสนับสนุนความต้องการในการใช้ยานี้ได้อย่างเพียงพอ จึงได้มีการย้ายฐานการผลิตไปยังสหรัฐอเมริกา ซึ่งมีกำลังการผลิตที่มากกว่า จนกระทั่งสงครามโลกครั้งที่ 2 สิ้นสุดลง จึงได้มีการผลิตเพนิซิลลินออกสู่ตลาดยาสาธารณะ อย่างไรก็ตาม ถึงแม้ว่ายาปฏิชีวนะที่มีอยู่ในตลาดยาทุกวันนี้ส่วนใหญ่จะได้มาจากการสังเคราะห์ของจุลชีพ (เช่น เพนิซิลลิน) แต่ด้วยความก้าวหน้าของเทคโนโลยีชีวภาพทำให้สามารถเพิ่มศักยภาพการผลิตได้มากขึ้น จนสามารถผลิตในเชิงการค้าได้ในที่สุด ด้วยความก้าวนี้ทำให้สามารถผลิตเพนิซิลลินได้มากกว่าวิธีการสกัดแรกเริ่มของเฟลมมิงถึง 40000 เท่า[146] ต่อมาในช่วงปลายทศวรรษที่ 1960 นักวิจัยพบว่าแบคทีเรียที่ผลิตเพนิซิลลินนั้นสามารถเจริญได้ดีในสภาวะที่ไม่มีออกซิเจน การค้นพบนี้ทำให้ศักยภาพการผลิตเพนิซิลลินเพิ่มขึ้นอีกถึง 200 %[147]
หลังจากการค้นพบเพนิซิลลินเพียงไม่กี่ปี พบว่ายาดังกล่าวเป็นที่นิยมและแพร่หลายเป็นอย่างมาก โดยในปี ค.ศ. 1945 มีการผลิตเพนิซิลลินขึ้นมากถึง 646 พันล้านยูนิต แต่ต่อมาหลังมีการพัฒนายากลุ่มดังกล่าวจนได้เป็นยากลุ่มเซฟาโลสปอริน ทำให้แนวโน้มการใช้ยาปฏิชีวนะนั้นโน้มเอียงมาทางยากลุ่มนี้มากขึ้น โดยในปี ค.ศ. 1980 ยากลุ่มเซฟาโลสปอรินเป็นยาปฏิชีวนะที่ถูกผลิตขึ้นเชิงการค้ามากที่สุด ตามมาด้วยแอมพิซิลลิน และเตตราไซคลีน ตามลำดับ เป็นที่คาดการณ์กันว่าในปีนั้นมีการผลิตยาปฏิชีวนะในปริมาณรวมมากถึง 100 ล้านกิโลกรัม มูลค่าการซื้อขายเฉพาะยาปฏิชีวนะในสหรัฐอเมริกาในปีนั้นมีมากถึง 1000 ล้านดอลลาร์สหรัฐ ส่วนมูลค่าทางการตลาดของยาปฏิชีวนะทั้งหมดในปัจจุบันนั้นมีมูลค่าประมาณ 20000 ล้านดอลลาร์สหรัฐ[147] ทั้งนี้ ในการคิดค้นและพัฒนายาปฏิชีวนะชนิดใหม่เข้าสู่ตลาดยาในปัจจุบันนั้นต้องใช้งบประมาณประมาณ 1200 ล้านดอลลาร์สหรัฐ[148] แต่ด้วยมูลค่าทางการตลาดที่มหาศาลของยาปฏิชีวนะชนิดหนึ่งๆ ทำให้ธุรกิจด้านการคิดค้นพัฒนายาชนิดนี้ออกจำหน่ายในตลาดยานั้นมีการแข่งขันกันเป็นอย่างมาก โดยการดำเนินงานวิจัยเพื่อคิดค้นและพัฒนายาใหม่ในปัจจุบันมักเป็นการดำเนินงานโดยบริษัทที่เน้นการดำเนินธุรกิจจัดจำหน่ายเคมีภัณฑ์และโภคภัณฑ์ (Commodity chemical) เป็นส่วนมาก[149]
การผลิตยาปฏิชีวนะเชิงอุตสาหกรรมจากจุลชีพนั้นจะใช้กระบวนการการหมัก ซึ่งจุลชีพเหล่านั้นจะถูกเพาะเลี้ยงในหม้อคอลดรอนขนาดใหญ่ (ปริมาตรประมาณ 100000–150000 ลิตรต่อหม้อ) ซึ่งภายในจะบรรจุอาหารเลี้ยงเชื้อที่จำเพาะต่อจุลชีพสายพันธุ์นั้นๆ โดยจะมีการควบคุมสภาวะต่างๆ อาทิ ความเข้มข้นของออกซิเจน อุณหภูมิ ค่าพีเอช และระดับสารอาหาร ให้มีเหมาะสมต่อการเจริญเติบโตของจุลชีพที่ใช้ในกระบวนการผลิต ส่วนยาปฏิชีวนะซึ่งเป็นสารเมตาบอไลต์ของจุลชีพนั้นจะถูกสกัดออกมาให้บริสุทธิ์และทำให้ตกผลึก ทั้งนี้ขั้นตอนและกระบวนการสกัดยาปฏิชีวนะให้บริสุทธิ์จะขึ้นอยู่กับสมบัติทางเคมีของยานั้นๆ ตัวอย่างกระบวนการที่ใช้ในการผลิต เช่น การแลกเปลี่ยนไอออน, การตกตะกอน เป็นต้น โดยจุลินทรีย์ที่ได้รับการศึกษาเพื่อการสร้างยาปฏิชีวนะมากที่สุดคือแบคทีเรียสกุลสเตรปโตมัยซิส[150] กว่า 77 สายพันธ์ของแบคทีเรียในสกุลนี้ได้รับการตกแต่งสารพันธุกรรมบนไรโบโซมเพื่อสร้างยาปฏิชีวนะชนิดใหม่ขึ้นมา[151]
ความสำคัญทางการแพทย์ของยาต้านจุลชีพ ซึ่งรวมไปถึงยาปฏิชีวนะนั้น ได้นำมาซึ่งการค้นคว้าวิจัยเพื่อคิดค้นพัฒนายาปฏิชีวนะชนิดใหม่อย่างกว้างขวางและเข้มข้น ทำให้เกิดพยายามที่จะพัฒนายาปฏิชีวนะชนิดใหม่ที่สามารถออกฤทธิ์ครอบคลุมเชื้อก่อโรคได้เป็นวงกว้างมากขึ้น, มีการปรับเปลี่ยนขนาดภาคการผลิตยาปฏิชีวนะโดยใช้กระบวนการหมักเชื้อในเชิงอุตสาหกรรมเพิ่มมากขึ้น[147] จากความพยามดังข้างต้นของนักวิจัย ทำให้จำนวนยาปฏิชีวนะที่ถูกค้นพบมีจำนวนเพิ่มขึ้นอย่างรวดเร็วจาก 500 ชนิดในทศวรรษที่ 1960 เป็นมากกว่า 11000 ชนิดในปี ค.ศ. 1994 โดยกว่าร้อยละ 50 ของยาปฏิชีวนะเหล่านี้ได้มาจากการสังเคราะห์ของแบคทีเรียสกุลสเตรปโตมัยซิส[152] ส่วนจุลชีพสายพันธุ์อื่นที่มีความสำคัญในการผลิตยาปฏิชีวนะ ได้แก่ ราเส้นใย และแอคติโนมัยสีทสายพันธุ์อื่นที่นอกเหนือจากสกุลสเตรปโตมัยซิส[153]
การตกค้างของยาปฏิชีวนะ
การใช้ยาปฏิชีวนะในปศุสัตว์เป็นสิ่งจำเป็นเนื่องจากต้องมีการป้องกันและรักษาโรคติดเชื้อแบคทีเรียที่เกิดขึ้นกับสัตว์เหล่านั้น[145] การค้นพบการประยุกต์ใช้ยาปฏิชีวนะและวัคซีนบางชนิดในปศุสัตว์นี้ทำให้การเลี้ยงวัวในปริมาณมากนั้นมีความสะดวกมากขึ้น เนื่องจากกระบวนการดังกล่าวจะลดการเกิดโรคติดเชื้อในสัตว์ การใช้ยาปฏิชีวนะในกรณีนี้ทำให้ปศุสัตว์นั้นมีการเจริญเติบโตที่เร็วมากขึ้น ให้ผลผลิตที่มีคุณภาพและปริมาณมากขึ้น[154] อย่างไรก็ตาม การใช้ยาปฏิชีวนะในการปศุสัตว์นี้ทำให้เกิดการตกค้างของยาปฏิชีวนะในผลิตภัณฑ์ต่างๆซึ่งอาจนำไปสู่การเกิดอันตรายแก่มนุษย์ได้ อาทิ การสะสมของสารหนูซึ่งเป็นส่วนประกอบหนึ่งของโมเลกุลยาปฏิชีวนะบางชนิดในร่างกายมนุษย์ ซึ่งรวมไปถึงการลดทอนประสิทธิภาพการรักษาโรคติดเชื้อแบคทีเรียในมนุษย์ลง ซึ่งเป็นผลเนื่องมาจากการปรับตัวของแบคทีเรียก่อโรคให้ทนต่อยาปฏิชีวนะมากขึ้น[155] ดังนั้น ในปัจจุบัน การตรวจสอบการตกค้างยาปฏิชีวนะตกค้างในผลิตภัณฑ์จากการปศุสัตว์อย่างเข้มข้นและต่อเนื่องจึงเป็นมาตรการสำคัญที่ช่วยรับประกันความปลอดภัยของสินค้าจากการปศุสัตว์นั้นๆได้ก่อนส่งถึงมือผู้บริโภค[156] นอกจากนี้การใช้ยาปฏิชีวนะในการปศุสัตว์ยังเป็นอีกสาเหตุหนึ่งที่ทำให้เกิดการตกค้างของยาปฏิชีวนะในสิ่งแวดล้อมจากการปล่อยของเสียจากสัตว์ลงสู่พื้นดิน หรือแหล่งน้ำธรรมชาติ เช่น แม่น้ำ ทะเลสาบ เป็นต้น[157]
การดื้อยาของจุลชีพ
การดื้อต่อยาปฏิชีวนะของแบคทีเรียนั้นเป็นภาวะฉุกเฉินภาวะฉุกเฉินที่พบเกิดขึ้นทั่วทุกมุมโลกในปัจจุบัน โดยการดื้อต่อยาปฏิชีวนะของแบคทีเรียเป็นการตอบสนองและการปรับตัวเพื่อความอยู่รอดในขณะที่มีการใช้ยาปฏิชีวนะเพื่อกำจัดเชื้อแบคทีเรียนั้นๆ โดยการดื้อยานี้อาจเกิดจากการปรับตัวทางกายภาพหรือทางพันธุกรรมของแบคทีเรียนั้นก็ได้ ซึ่งจะช่วยเพิ่มโอกาสในการอยู่รอดของเชื้อเพิ่มขึ้นแม้จะมีการใช้ยาปฏิชีวนะในขนาดที่สูงขึ้นก็ตาม ในบางสภาวะการใช้ยาปฏิชีวนะอาจทำให้เกิดการเจริญเติบโตของแบคทีเรียดื้อมากขึ้น ในขณะที่แบคทีเรียซึ่งยังมีความไวต่อยาถูกกำจัดออกไป[158] ตัวอย่างเช่น การใช้ยาปฏิชีวนะในการคัดแยกสายพันธุ์แบคทีเรียที่ได้รับการตกแต่งพันธุกรรมด้วยยีนดื้อยาในปี ค.ศ. 1943 โดยเรียกการทดลองนี้ว่า การทดลองของเดลบรัค–ลูเรีย (Luria–Delbrück experiment)[159] สถานการณ์การดื้อต่อยาปฏิชีวนะของแบคทีเรียในปัจจุบันนี้พบว่า ยาปฏิชีวนะหลายชนิดที่มีประสิทธิภาพในการต้านเชื้อแบคทีเรียหลากหลายสายพันธุ์ในอดีต เช่น เพนิซิลลิน และอิริโทรมัยซิน กลับมีประสิทธิภาพในการรักษาโรคติดเชื้อแบคทีเรียต่างๆได้น้อยลง ทั้งนี้เนื่องมาจากอัตราการดื้อต่อยาปฏิชีวนะของแบคทีเรียมีเพิ่มขึ้นมากกว่าในอดีต[160]
การดื้อต่อยาปฏิชีวนะของแบคทีเรียอาจเกิดขึ้นได้รูปแบบการย่อยสลายทางชีวภาพของยาปฏิชีวนะ ดังเช่นในกรณีของแบคทีเรียในดินที่ทำหน้าที่ย่อยสลายซัลฟาเมทาซีน ซึ่งได้รับซัลฟาเมทาซีนที่ปนเปื้อนออกมากับอุจจาระของหมู[161] โดยการปรับตัวให้อยู่รอดจากยาปฏิชีวนะได้นี้ส่วนใหญ่แล้วมักเกิดถ่ายทอดทางพันธุกรรมได้[162] แต่ในกรณีการเจริญเติบโตของแบคทีเรียที่ดื้อต่อยาปฏิชีวนะนั้นมักเกิดจากการที่แบคทีเรียหนึ่งๆ ได้รับยีนต้านทานยาปฏิชีวนะมาจากแบคทีเรียเซลล์อื่น (horizontal gene transfer) โดยกระบวนการถ่ายทอดยีนนี้มักเกิดขึ้นได้บ่อยในพื้นที่ที่มีการใช้ยาปฏิชีวนะสูง[163]
ข้อมูลที่ได้จากการศึกษาทางโบราณคดีพบว่าการดื้อต่อยาปฏิชีวะในแบคทีเรียนั้นเป็นกลไกที่พบเกิดขึ้นได้ตั้งแต่สมัยโบราณ[164] ทำให้เกิดการกลายพันธุ์ของเชื้อแบคทีเรียจนได้เป็นสายพันธุ์ที่ทนสารที่ออกฤทธิ์เป็นยาปฏิชีวนะที่เคยใช้ได้ผลในการยับยั้งการสืบพันธุ์และการดำรงชีวิตของแบคทีเรียนั้นๆในอดีต[165]
กลไกการดื้อต่อยาปฏิชีวนะของแบคทีเรียในระดับโมเลเท่าที่ทราบในปัจจุบันนั้น การดื้อยาต่อยาปฏิชีวนะของแบคทีเรียตั้งแต่กำเนิด (Intrinsic resistance) อาจจะเป็นส่วนหนึ่งของการเปลี่ยนแปลงสารพันธุกรรม (genetic makeup) ของแบคทีเรียสายพันธ์นั้น[166][167] ตัวอย่างเช่น ตำแหน่งที่เป็นเป้าหมายการออกฤทธิ์ของยาปฏิชีวนะอาจจะหายไปจากจีโนมของแบคทีเรีย ส่วนการดื้อต่อยาปฏิชีวนะของแบคทีเรียที่เกิดภายหลัง (Acquired resistance) นั้นจะเป็นผลมาจากการกลายพันธุ์ในโครโมโซมของแบคทีเรีย หรือการได้รับยีนดื้อยาจากแบคทีเรียอื่นผ่านทางดีเอ็นเอที่อยู่นอกโครโมโซม (extra-chromosomal DNA)[166] ทั้งนี้ ในแบคทีเรียบางสายพันธุ์ที่สามารถผลิตสารที่ออกฤทธิ์เป็นยาปฏิชีวนะได้นั้นจะสามารถดื้อต่อยาปฏิชีวนะดังกล่าวได้อย่างอัตโนมัตและอาจมีการถ่ายทอดความสามารถในการดื้อต่อยาปฏิชีวนะนี้ไปยังแบคทีเรียอื่นๆได้เช่นกัน[168][169] การแพร่กระจายของแบคทีเรียที่ดื้อต่อยาปฏิชีวนะนั้นส่วนใหญ่จะพบในรูปแบบถ่ายทอดพันธุกรรมจากรุ่นสู่รุ่นหรือการติดต่อตามแนวดิ่ง (vertical transmission) และโดยการรวมตัวกันใหม่ของยีน (Genetic Recombination) ในดีเอ็นเอโดยการถ่ายทอดยีนในแนวราบ (Horizontal gene transfer)[162] โดยแบคทีเรียดื้อยาสามารถถ่ายทอดยีนดื้อยาที่ถูกบรรจุอยู่ในพลาสมิดไปยังสเตรนอื่นหรือสายพันธุ์อื่นได้[162][170] โดยพลาสมิดบางชนิดที่บรรจุยีนดื้อยาที่แตกต่างกันไว้หลายยีนสามารถทำให้แบคทีเรียที่ดื้อต่อยาปฏิชีวนะหายขนานได้[170] โดยการดื้อยาปฏิชีวนะข้ามชนิดหนือข้ามกลุ่มกันในเชื้อแบคทีเรียนั้นอาจพบเกิดขึ้นได้ในกรณีที่กลไกการดื้อต่อยาเหล่านั้นถูกควบคุมโดยยีนตำแหน่งเดียวกัน[170]
ในปัจจุบัน โรคที่เกิดจากการติดเชื้อแบคทีเรียสายพันธุ์หรือสเตรนที่ดื้อต่อยาปฏิชีวนะ หรือในบางครั้งอาจเรียกว่า ซูเปอร์บั๊ก (superbugs) เป็นโรคที่การสาธารณสุขทั่วโลกต่างเห็นพ้องว่าเป็นโรคที่ต้องมีการควบคุมโรคเป็นอย่างดี เนื่องจากอาจเกิดการแพร่กระจายและเกิดการติดต่อเป็นวงกว้างได้ ยกตัวอย่างเช่นภาวะฉุกเฉินที่เกิดจากวัณโรคที่ดื้อต่อยาต้านวัณโรคหลายขนาน (Multidrug-resistant tuberculosis; MDR-TB) ซึ่งเชื้อแบคทีเรียสาเหตุดังกล่าวนั้นดื้อต่อยาต้านวัณโรคหลายชนิดที่เคยมีประสิทธิภาพดีในการรักษาวัณโรคหลายอดีต โดยในทุกๆปีจะมีผู้ป่วยรายใหม่มากกว่าครึ่งล้านที่เจ็บป่วยจากการติดเชื้อวัณโรคที่ดื้อต่อยาปฏิชีวนะหลายขนานสายพันธุ์[171] โดยกลไกการดื้อยาดังกล่าวนั้นเกิดได้จากหลากลายกลไก การศึกษาทางคลินิกในปัจจุบันพบว่าเอนไซม์ NDM-1 เป็นเอนไซม์ที่สำคัญอีกชนิดหนึ่งที่ชักนำให้แบคทีเรียเกิดการดื้อต่อยาปฏิชีวนะในกลุ่มบีตา-แลคแตมได้หลายชนิด[172] สำนักงานคุ้มครองสุขภาพ (Health Protection Agency) ของสหราชอาณาจักร ได้ให้ถ้อยแถลงไว้ว่า แบคทีเรียที่มีการสร้างเอนไซม์ NDM-1 ซึ่งคัดแยกได้จากสารคัดหลั่งของผู้ป่วยนั้นดื้อต่อยาปฏิชีวนะรูปแบบฉีดในสูตรการรักษามาตรฐานทุกชนิดของการรักษาโรคติดเชื้อแบคทีเรียที่รุนแรง[173] ในวันที่ 26 พฤษภาคม ค.ศ. 2016 ได้มีการรายงานถึงการพบแบคทีเรียสายพันธุ์ Escherichia coli ที่ดื้อต่อโคลิสตินเป็นครั้งแรกในสหรัฐอเมริกา ซึ่งยาดังกล่าวนั้นถือได้ว่าเป็น “ยาที่ถูกเลือกใช้เป็นอันดับสุดท้าย” (Drug of last resort) หรือยาทางเลือกสุดท้ายที่มีใช้ในกรณีที่ภาวะติดเชื้อนั้นไม่สามารถบำบัดรักษาได้ด้วยยาปฏิชีวนะชนิดอื่น หรือเฉพาะโรคที่เกิดจากการติดเชื้อแบคทีเรียที่ดื้อต่อยาปฏิชีวนะหลายขนาน[174][175]
การใช้ยาปฏิชีวนะในทางที่ผิด

หลักการสำคัญในการตัดสินใจเลือกใช้ยาปฏิชีวนะเมื่อเกิดการเจ็บป่วยนั้น อย่างง่ายคือ หลีกเลี่ยงการใช้ยาปฏิชีวนะถ้าไม่จำเป็น และหากมีความจำเป็นต้องใช้ยาดังกล่าวก็ไม่ควรที่จะใช้ในจำนวนที่มากเกินจำเป็น[176]เนื่องจากในปัจจุบันการใช้ยาปฏิชีวนะที่ไม่เหมาะสมกับภาวะการเจ็บป่วยหรือใช้มากเกินจำเป็นถือเป็นปัจจัยสำคัญที่ก่อให้เกิดการดื้อต่อยาปฏิชีวนะของแบคทีเรีย ซึ่งถือเป็นอีกประเด็นหนึ่งที่ถูกจัดเป็นภาวะฉุกเฉินทางการแพทย์ในปัจจุบัน ตัวอย่างที่พบเห็นได้ทั่วไปของการใช้ยาปฏิชีวนะที่ไม่เหมาะสมก็คือ การจัดหายาปฏิชีวนะมาใช้เองโดยปราศจากการวินิจฉัยหรือการดูแลที่เหมาะสมจากแพทย์[177] อย่างไรก็ตาม การสั่งใช้ยาปฏิชีวนะจากบุคลการทางการแพทย์แก่ผู้ป่วยที่เจ็บป่วยด้วยโรคหรืออาการที่ไม่อาจตอบสนองต่อการรักษาด้วยยาปฏิชีวนะ รวมไปถึงโรคหรืออาการบางชนิดที่อาจหายได้เองโดยไม่จำเป็นต้องได้รับการรักษาด้วยยาใดๆ และการใช้ยาปฏิชีวนะเพื่อรักษาโรคที่เกิดจากการติดเชื้อแบคทีเรียในขนาดหรือระยะเวลาที่ต่ำเกินกว่าที่แนะนำในแบบแผนการรักษามาตรฐาน ล้วนแล้วแต่เป็นสาเหตุที่ก่อให้เกิดการดื้อต่อยาปฏิชีวนะของแบคทีเรียได้ทั้งสิ้น[67][177] โดยการใช้ยาปฏิชีวนะเกินความจำเป็น อย่างเช่นในกรณีของเพนิซิลลินและอิริโทรมัยซินนั้น พบว่ามีความสัมพันธ์ภาวะฉุกเฉินด้านการดื้อต่อยาปฏิชีวนะของแบคทีเรียมาตั้งแต่คริสต์ทศวรรษที่ 1950[160][178] รวมไปถึงการที่มีการใช้ยาปฏิชีวนะในสถานพยาบาลต่างๆอย่างแพร่หลายก็ล้วนมีความสัมพันธ์กับการเกิดการดื้อต่อยาปฏิชีวนะและการเพิ่มขึ้นของจำนวนสายพันธุ์และสเตรนของแบคทีเรียเช่นกัน ซึ่งการดื้อยาของแบคทีเรียนี้เป็นสาเหตุให้โรคติดเชื้อแบคทีเรียหลายชนิดไม่อาจสามารถรักษาได้ด้วยยาปฏิชีวนะทั่วไปในปัจจุบัน[178]
นอกเหนือจากประเด็นดังข้างต้นแล้ว การใช้ยาปฏิชีวนะเกินความจำเป็นสำหรับการป้องกันโรคติดเชื้อแบคทีเรีย และความผิดพลาดในการสั่งใช้และกำหนดขนาดยาปฏิชีวนะให้กับผู้ป่วยของบุคลากรทางการแพทย์ โดยอิงข้อมูลจากคุณลักษณะพื้นฐานและประวัติการรักษาของผู้ป่วยแต่ละราย ก็ล้วนแล้วแต่เป็นสาเหตุของการเกิดการดื้อต่อยาปฏิชีวนะของแบคทีเรียที่พบเห็นได้เป็นประจำ ส่วนสาเหตุอื่นที่อาจพบได้ อาทิ การที่ผู้ป่วยรับประทานยาไม่ครบจำนวนวันตามที่ได้รับการสั่งใช้ยาจากแพทย์ การที่ผู้ป่วยรับประทานยาไม่ได้ขนาดและมีวิธีการบริหารยาที่ไม่ตรงตามที่มีการสั่งใช้ยา หรือการที่ไม่สามารถพักฟื้นได้เพียงพอหลังการรักษา นอกจากนี้การใช้ยาปฏิชีวนะไม่ตรงตามข้อบ่งใช้อย่างการใช้ยาดังกล่าวในการรักษาโรคที่เกิดจากการติดเชื้อไวรัส เช่น โรคหวัด ก็เป็นสาเหตุสำคัญอีกประการหนึ่งที่นำไปสู่การเกิดภาวะฉุกเฉินด้านการดื้อยาของแบคทีเรียได้ โดยการศึกษาหนึ่งพบว่า แพทย์มักสั่งจ่ายยาปฏิชีวนะให้แก่ผู้ป่วยที่มีความต้องการที่จะใช้ยาดังกล่าว ถึงแม้ว่าการสั่งใช้ยานี้จะไม่ตรงตามข้อบ่งใช้ก็ตาม[179] จึงอาจถือได้ว่า การกำหนดมาตรการป้องกันการใช้ยาปฏิชีวนะที่ไม่ตรงตามข้อบ่งใช้ทั้งในด้านการสั่งใช้ยาของแพทย์และการรับรู้ของผู้ป่วยนั้นเป็นปัจจัยสำคัญที่จะช่วยลดการใช้ยาปฏิชีวนะที่ไม่เหมาะสมลงได้[180][181]
การดื้อต่อยาปฏิชีวนะของแบคทีเรียในปัจจุบันกำลังอยู่ในความสนใจขององค์กรที่เกี่ยวเนื่องกับระบบสาธารณสุขหลายองค์กร ดดยองค์กรเหล่านั้นได้พยายามผลักดันให้มีการบังคับใช้มาตรการต่างๆออกมาอย่างต่อเนื่องเพื่อลดปริมาณการใช้ยาปฏิชีวนะที่ไม่สมเหตุสมผล[177] โดยประเด็นการใช้ยาปฏิชีวนะไปในทางที่ผิดและการใช้ยาปฏิชีวนะเกินความจำเป็นได้ถูกบรรจุให้เป็นประเด็นสำคัญในถ้อยแถลงการก่อตั้งหน่วยเฉพาะกิจร่วมด้านการดื้อต่อยาปฏิชีวนะของแบคทีเรียแห่งประเทศสหรัฐอเมริกา โดยหน่วยเฉพาะกิจนี้มีวัตถุประสงค์ในการจัดการและแก้ไขปัญหาดังข้างต้นเป็นหลัก โดยอาศัยความร่วมมือหลักจากองค์กรที่เกี่ยวเนื่อง 3 องค์กร คือ ศูนย์ควบคุมและป้องกันโรค (Centers for Disease Control and Prevention; CDC) องค์การอาหารและยา (Food and Drug Administration; FDA) และสถาบันสุขภาพแห่งชาติ (National Institutes of Health;NIH) รวมไปถึงหน่วยงานอื่นที่เกี่ยวเนื่องอีกหลายหน่วยงาน[182] นอกจากนี้ยังมีโครงการ Keep Antibiotics Working ซึ่งริเริ่มโดยกลุ่มองค์การนอกภาครัฐ เพื่อประชาสัมพันธ์ให้ประชาชนตระหนักถึงอันตรายของแบคทีเรียที่ดื้อต่อยาปฏิชีวนะ[183] ส่วนในฝรั่งเศส ได้มีการริเริ่มโครงการ Antibiotics are not automatic โดยหน่วยงานภาครัฐขึ้นใน ค.ศ. 2002 และนำไปสู้การลดลงของการสั่งใช้ยาปฏิชีวนะโดยไม่จำเป็นได้ในที่สุด โดยเฉพาะอย่าง การใช้ยากลุ่มดังกล่าวในผู้ป่วยวัยเด็ก[184]
ภาวะฉุกเฉินทางการแพทย์ด้านการดื้อยาปฏิชีวนะของแบคทีเรียนั้นส่งผลให้การใช้ยาปฏิชีวนะในสหราชอาณาจักรมีความเข้มงวดมากขึ้นตั้งแต่ปี ค.ศ. 1970 (ตามรายงานของ Swann ระบุว่าเริ่มใน ค.ศ. 1969) และสหภาพยุโรปได้ประกาศห้ามใช้ยาปฏิชีวนะเป็นสารช่วยส่งเสริมการเจริญเติบโต (growth-promotional agent) ในปี ค.ศ. 2003[185] นอกจากนี้ องค์กรและหน่วยงานด้านสุขภาพหลายองค์กร (รวมถึงองค์การอนามัยโลก สถาบันวิทยาศาสตร์แห่งชาติ และองค์การอาหารและยาของสหรัฐอเมริกา) ได้เข้ามาส่วนสนับสนุนในการจำกัดปริมาณการใช้ยาปฏิชีวนะในการเพาะเลี้ยงปศุสัตว์เพื่อการบริโภค[186] อย่างไรก็ตาม การดำเนินการนี้ต้องล่าช้าลงในขั้นตอนของการร่างกฎหมายและการดำเนินการตามขั้นตอนต่างๆ ทางกฎหมายเพื่อจำกัดการใช้ยาปฏิชีวนะในอุตสาหกรรมดังกล่าว เนื่องมาจากต้องเผชิญแรงต้านจากหน่วยงานเอกชนที่ใช้หรือจำหน่ายยาปฏิชีวนะที่ต้องอยู่ภายใต้การกำกับดูแลของภาครัฐ และจำเป็นต้องใช้เวลาในการศึกษาวิจัยเพิ่มเติมเพื่อยืนยันให้ได้แน่ชัดว่าการใช้ยาปฏิชีวนะในอุตสาหกรรมปศุสัตว์นั้นมีความสัมพันธ์กับการเกิดการดื้อยาปฏิชีวนะของแบคทีเรีย โดยร่างกฎหมายของรัรัฐบาลกลางจำนวน 2 ฉบับ (S.742[187] และ H.R. 2562[188]) ซึ่งมีใจความสำคัญที่เกี่ยวเนื่องกับการยกเลิกการใช้ยาปฏิชีวนะที่ไม่ได้มีจุดประสงค์เพื่อการรักษาในการอุตสาหกรรมการผลิตสัตว์เพื่อการบริโภคในสหรัฐอเมริกาได้ถูกเสนอเข้าในการประชุมของรัฐบาลกลาง แต่ร่างกฎหมายนี้ไม่ผ่านการเห็นชอบในที่ประชุมและมีจำเป็นต้องตกไป[187][188] โดยร่างกฎหมายทั้ง 2 ฉบับดังกล่าวนั้นได้รับการรับรองและความเห็นชอบจากองค์กรทางการแพทย์และการสาธารณสุขหลายองค์กี ได้แก่ สมาคมพยาบาลแบบองค์รวมอเมริกัน (American Holistic Nurses' Association; AHNA) สมาคมการแพทย์อเมริกัน (American Medical Association; AMA) และสมาคมสาธารณสุขอเมริกา (American Public Health Association; APHA)[189]
อย่างไรก็ตาม ถึงแม้จะมีคำมั่นสัญญาที่จะลดหรือยกเลิกการใช้เนื้อสัตว์ที่มีแหล่งที่มาจากฟาร์มที่มีการใช้ยาปฏิชีวนะจากบริษัทผลิตอาหารและภัตตาคารต่างๆหลายแห่งก็ตาม การจำหน่ายยาปฏิชีวนะเพื่อใช้ในอุตสาหกรรมการผลิตสัตว์เพื่อการบริโภคนั้นก็ยังคงมีจำนวนที่เพิ่มมากขึ้นในทุกๆปี[190] ซึ่งชี้ให้เห็นว่ายังมีการใช้ยาปฏิชีวนะในการปศุสัตว์อยู่เป็นจำนวนมาก โดยในสหรัฐอเมริกา การดื้อยาปฏิชีวนะของแบคทีเรียที่มีสาเหตุมาจากการใช้ยาปฏิชีวนะในการปศุสัตว์นั้นได้เป็นประเด็นที่ได้รับการตั้งข้อสงสัยเป็นอย่างมากจากองค์การอาหารและยามาตั้งแต่ปี ค.ศ. 1977 โดยในเดือนมีนาคม ค.ศ. 2012 สภาป้องกันทรัพยากรธรรมชาติ (Natural Resources Defense Council; NRDC) และกลุ่มรณรงค์ด้านผู้บริโภคและสิ่งแวดล้อมอีก 5 กลุ่มได้ร่วมกันยื่นคำร้องต่อศาลชั้นต้นสหรัฐอเมริกาแห่งเซาท์เทิร์นดิสทริคของรัฐนิวยอร์กให้มีคำสั่งให้องค์การอาหารและยาเพิกถอนการรับรองให้ใช้ยาปฏิชีวนะในการปศุสัตว์ ซึ่งการรับรองให้ใช้ยาปฏิชีวนะในกรณีดังกล่าวนั้นถือว่าองค์การอาหารและยาละเมิดกฏข้อบังคับขององค์กรที่ตั้งไว้ตั้งแต่ ค.ศ. 1977[191]
การศึกษาวิจัย
ยารักษาทางเลือก
ส่วนนี้รอเพิ่มเติมข้อมูล คุณสามารถช่วยเพิ่มข้อมูลส่วนนี้ได้ |
สารลดการดื้อยา
ส่วนนี้รอเพิ่มเติมข้อมูล คุณสามารถช่วยเพิ่มข้อมูลส่วนนี้ได้ |
วัคซีน
ส่วนนี้รอเพิ่มเติมข้อมูล คุณสามารถช่วยเพิ่มข้อมูลส่วนนี้ได้ |
เฟจเพื่อการรักษาโรค

เฟจเพื่อการรักษาโรค เป็นการรักษาอีกวิธีหนึ่งที่ถูกนำมาใช้ในการรักษาโรคที่เกิดจากการติดเชื้อแบคทีเรียที่ดื้อต่อยาปฏิชีวนะ โดยการรักษาแบบเฟจเพื่อการรักษาโรคนี้จะเป็นการทำให้แบคทีเรียก่อโรคนั้นๆเกิดการติดเชื้อไวรัสที่มีแบคทีเรียดังกล่าวเป็นโฮสต์จำเพาะ โดยไวรัสดังกล่าวจัดเป็นแบคเทอริโอฟาจ (bacteriophage) หรือเรียกโดยย่อว่า ฟาจ เป็นไวรัสที่ต้องอาศัยอยู่กับเซลล์ของแบคทีเรียเพื่อการเจริญและเพิ่มจำนวน โดยฟาจแต่ละชนิดจะมีความจำเพาะต่อแบคทีเรียสายพันธุ์ใดสายพันธุ์หนึ่งเป็นอย่างมาก ดังนั้นฟาจดังกล่าวจึงไม่ส่งผลกระทบต่อจุลชีพอื่นๆ หรือจุลชีพประจำถิ่นในทางเดินอาหารของโฮสต์ ซึ่งเป็นคุณสมบัติที่พบไม่ได้ในยาปฏิชีวนะที่มีใช้อยู่ในปัจจุบัน[192] แบคเทอริโอฟาจสามารถทำให้แบคทีเรียก่อโรคเกิดการติดเชื้อได้และส่งผลกระทบต่อการเจริญเติบโตหรือฆ่าเซลล์แบคทีเรียนั้นๆ ได้โดยการทำให้เกิดการแตกออกของเซลล์ (lytic cycle)[192][193] โดยฟาจจะเข้าจับกับเซลล์แบคทีเรียและแทรกสอดดีเอ็นเอของตนเข้าไปในเซลล์นั้น ซึ่งดีเอ็นเอเหล่านั้นจะถูกถอดรหัสพันธุกรรมและสังเคราะห์ส่วนประกอบชีวภาพของฟาจใหม่ขึ้นภายในเซลล์ของแบคทีเรีย ทำให้มีฟาจใหม่เกิดขึ้นภายในเซลล์แบคทีเรียจำนวนมาก จนเกิดการแตกออกของเซลล์นั้นๆในที่สุด โดยฟาจใหม่ที่เกิดขึ้นนี้จะเข้าทำลายเซลล์อื่นของแบคทีเรียในสายพันธ์ุเดิมด้วยกระบวนการข้างต้นต่อไป[193] การที่ฟาจมีความจำเพาะต่อแบคทีเรียสายพันธุ์หนึ่งๆเป็นอย่างมากนี้จะช่วยให้แบคทีเรียอื่นที่เป็นประโยชน์ต่อโฮสต์ไม่ถูกทำลายไปด้วย อย่างไรก็ตาม การใช้ฟาจในการรักษานี้ก็มีข้อเสียเช่นเดียวกันกับการรักษาด้วยวิธีอื่นๆ โดยจีโนมที่ฟาจแทรกสอดเข้ามาในเซลล์ของแบคทีเรียนั้นอาจมียีนหรือสารอื่นที่ก่อให้เกิดพิษสอดแทรกอยู่ ดังนั้น จึงต้องมีการศึกษาและจำแยกยีน สารประกอบหรือสารพิษต่างๆจากฟาจนั้นอย่างละเอียดและรอบคอบก่อนนำมาใช้ในทางคลินิก นอกจากนี้ การศึกษาเกี่ยวกับการรักษาโรคติดเชื้อแบคทีเรียด้วยฟาจนั้นพบว่าการบริหารยาทางช่องปากและการฉีดเข้าหลอดเลือดดำนั้นมีความเสี่ยงด้านความปลอดภัยที่สูงกว่าการบริหารยาโดยการทาบนพื้นผิว (topical application) และมีความกังวลเกียวกับการตอบสนองต่อระบบภูมิคุ้มกันที่ไม่แน่นอนต่อฟาจที่จัดเป็นแอนติเจนต่อร่างกายนี้ รวมไปถึงอุปสรรคด้านกฏหมายและจริยธรรมมากมายที่จำเป็นต้องได้รับการแก้ไขเพื่อให้รองรับและสอดคล้องกับการใช้เฟจเพื่อรักษาโรค[192] ถึงกระนั้น การใช้แบคเทอริโอฟาจเพื่อทดแทนยาต้านจุลชีพในการรักษาโรคติดเชื้อที่เกิดจากเชื้อดื้อยาหลายชนิดที่ไม่ตอบสนองต่อยาปฏิชีวนะแบบเดิมๆ ก็ยังคงเป็นตัวเลือกที่น่าสนใจแม้ว่าจะมีความท้าทายมากมายก็ตาม[192][194]
สารพฤกษเคมี
ในการคิดค้นและพัฒนายาต้านจุลชีพชนิดใหม่นั้น พืชถือว่าเป็นแหล่งที่มาสำคัญของสารประกอบที่มีฤทธิ์ต้านแบคทีเรียซึ่งอาจนำมาพัฒนาต่อยอดได้ ดังจะเห็นได้จากการใช้พืชสมุนไพรพื้นบ้านเพื่อการป้องกันและรักษาโรคที่เกิดจากการติดเชื้อจุลชีพต่างๆ ตั้งแต่ในอดีตจนถึงในปัจจุบัน[195][196] โดยในปัจจุบัน การพัฒนายาต้านจุลชีพใหม่หลายชนิดนั้นมีแนวโน้มที่จะมุ่งความสนใจไปยังการค้นคว้าสารประกอบจากผลิตภัณฑ์ธรรมชาติที่มีคุณสมบัติในการต้านจุลชีพ โดยเรียกสารเหล่านั้นว่าเป็นสารในกลุ่ม 'antibiotic-ome' (ซึ่งมีการให้นิยามว่าหมายถึง ผลิตภัณฑ์จากธรรมชาติที่มีฤทธิ์ต้านแบคทีเรีย) ซึ่งมีประโยชน์เป็นอย่างมากสำหรับการค้นคว้ายาต้านเชื้อแบคทีเรียในยุคปัจจุบันที่มีการศึกษาลึกถึงระดับจีโนม[197][198] โดยสารในพืชสมุนไพรที่ค้นพบว่ามีฤทธิ์ทางยานั้นจะถูกเรียกว่า สารพฤกษเคมี ซึ่งสารพฤกษเคมีบางชนิด ได้แก่ แทนนิน แอลคาลอยด์ เทอร์พีนอยด์ และฟลาโวนอยด์ พบว่ามีสมบัติในการต้านแบคทีเรียด้วย[195][199][200] นอกจากนี้ ผลการทดลองในเนื้อเยื่อนอกร่างกายมุนษย์ (in vitro) ของผลิตภัณฑ์เสริมอาหารจากธรรมชาติที่มีฤทธิ์ต้านอนุมูลอิสระบางชนิดที่มีส่วนประกอบเป็นสารพฤกษเคมี (สารกลุ่มโพลีฟีนอล) เช่น สารสกัดจากเมล็ดองุ่น พบว่าก็มีคุณสมบัติในการต้านแบคทีเรียเช่นกัน[201][202][203] โดยสารพฤกษเคมีที่มีฤทธิ์ต้านแบคทีเรียเหล่านี้มีกลไกการออกฤทธิ์ที่หลากหลายแตกต่างกันออกไปขึ้น โดยอาจออกฤทธิ์ยับยั้งการสังเคราะห์เปบทิโดไกลแคนซึ่งเป็นส่วนประกอบของผนังเซลล์แบคทีเรีย ทำให้เกิดความเสียหายต่อเยื่อหุ้มเซลล์ของแบคทีเรีย ปรับเปลี่ยนสมบัติความไม่เข้ากันกับน้ำ (hydrophobicity) ของพื้นผิวเยื่อหุ้มเซลล์แบคทีเรีย หรืออาจกระตุ้นระบบควอรัมเซนซิง (quorum-sensing) ของแบคทีเรียให้ผลิตสารที่เป็นสัญญาณระบุตำแหน่งที่เอื้อต่อการออกฤทธิ์ของยาปฏิชีวนะ[199] อย่างไรก็ตาม ถึงแม้ว่าในปัจจุบันอุบัติการณ์และความรุนแรงของการเกิดแบคทีเรียดื้อยาจะเพิ่มสูงขึ้นเป็นอย่างมาก แต่ยาปฏิชีวนะชนิดใหม่ที่เป็นอนุพันธ์ของสารประกอบจากสมุนไพรซึ่งได้รับการคาดหวังว่าจะช่วยบรรเทาความรุนแรงของภาวะฉุกเฉินดังกล่าวลงนั้น ยังอยู่ในระหว่างการศึกษาค้นคว้าในห้องปฏิบัติการเท่านั้น[198]
การพัฒนายาปฏิชีวนะชนิดใหม่
ในเดือนเมษายน ค.ศ. 2013 สมาคมโรคติดเชื้อแห่งสหรัฐอเมริกา (Infectious Disease Society of America; IDSA) reported that the weak antibiotic pipeline นั้นไม่มีความสัมพันธ์กับความสามารถในการดื้อยาปฏิชีวนะของแบคทีเรียที่เพิ่มมากขึ้น โดยนับตั้งแต่ ค.ศ. 2009 เป็นต้นมา พบว่ามีการค้นพบยาปฏิชีวนะชนิดใหม่และได้รับการรับรองให้ใช้กับมนุษย์ในสหรัฐอเมริกาเพียง 2 ชนิดเท่านั้น โดยในช่วงระยะเวลาหลายทศวรรษที่ผ่านมานั้น ยาปฏิชีวนะชนิดใหม่สำหรับมนุษย์ที่ได้รับการรับรองให้ผลิตเชิงการค้านั้นมีจำนวนที่ลดลงอย่างต่อเนื่องในทุกๆปี โดยในรายงานดังกล่าวระบุว่ามียาปฏิชีวนะชนิดใหม่จำนวน 7 รายการที่ออกฤทธิ์ต้านเชื้อแบคทีเรียแกรมลบสกุลบาซิลลัส (Gram-negative bacilli; GNB) ที่กำลังอยู่ระหว่างการศึกษาวิจัยทางคลินิกในขั้นที่ 2 และขั้นที่ 3 ถึงกระนั้น ยาดังกล่าวก็ไม่ได้มีขอบเขตการออกฤทธิ์ครอบคลุมเชื้อแบคทีเรียแกรมลบสกุลบาซิลลัสที่พบการดื้อยาปฏิชีวนะในปัจจุบัน[204][205] ตัวอย่างยาปฏิชีวนะชนิดใหม่ที่ถูกค้นพบหรือการนำยาปฏิชีวนะชนิดเดิมมาใช้ร่วมกับยาอื่นเพื่อป้องกันการเกิดการดื้อยาของแบคทีเรียหรือขยายขอบเขตการออกฤทธิ์ของยาปฏิชีวนะชนิดนั้นให้ครอบคลุมเชื้อแบคทีเรียได้หลากหลายมากขึ้น เช่น:
การศึกษาวิจัยเกี่ยวกับสารที่ได้จากแบคทีเรียสกุลสเตรปโตมัยซิสนั้นได้รับการคาดหวังจากวงการสาธารณสุขเป็นอย่างยิ่งว่าจะช่วยให้ค้นพบยาปฏิชีวนะชนิดใหม่ได้หลากหลายยิ่งขึ้น โดยเฉพาะอย่างยิ่งยาปฏิชีวนะที่ออกฤทธิ์ต้านสแตปฟิโลคอคคัส ออเรียสที่ดื้อต่อยาเมทิซิลลิน (Methicillin-resistant Staphylococcus aureus; MRSA) และแบคทีเรียอื่นที่ดื้อต่อยาปฏิชีวนะที่มีใช้อยู่ทั่วไปในปัจจุบัน ความพยายามที่จะทำการศึกษาในประเด็นดังกล่าวของจอห์น อินนส์ เซ็นเตอร์และมหาวิทยาลัยหลายแห่งในสหราชอาณาจักร ซึ่งได้รับการสนับสนุนจากสภาวิจัยด้านเทคโนโลยีชีวภาพและวิทยาศาสตร์ชีวภาพ (The Biotechnology and Biological Sciences Research Council; BBSRC) ทำให้มีการก่อตั้งบริษัทต่างๆเพื่อดำเนินงานด้านการวิจัยและพัฒนายาปฏิชีวนะชนิดใหม่เกิดขึ้นเป็นจำนวนมาก ตัวอย่างเช่น บริษัทโนวาคตาไบโอซิสเตมส์ (Novacta Biosystems Ltd.) ซึ่งเป็นบริษัทที่พัฒนาและออกแบบสารประกอบ NVB302 ซึ่งจัดเป็นยาปฏิชีวนะในกลุ่มแลนติไบโอติก ชนิดบี (type-b lantibiotic) เพื่อรักษาการติดเชื้อแบคทีเรีย Clostridium difficile โดยปัจจุบันยานี้กำลังอยู่ระหว่างการศึกษาวิจัยทางคลินิกในระยะที่ 1[215][216] อย่างไรก็ตาม ความเป็นไปได้ในการคิดค้นและพัฒนายาใหม่นั้นขึ้นอยู่กับการกำหนดข้อบังคับที่เกี่ยวเนื่องการทดลองทางคลินิกขององค์การอาหารและยา รวมไปถึงแรงจูงใจทางเศรษฐกิจที่เหมาะสมอาจชักชวนให้บริษัทยากล้าที่จะลงทุนในความพยายามนี้[205] ใน ค.ศ. 2013 เพื่อตอบสนองต่อการดื้อยาปฏิชีวนะของแบคทีเรียที่มีจำนวนและความรุนแรงที่เพิ่มมากขึ้น รัฐสภาสหรัฐได้มีมติเห็นชอบผ่านร่างกฏหมายการพัฒนายาปฏิชีวนะเพื่อการรักษาผู้ป่วยขึ้นสูง (Antibiotic Development to Advance Patient Treatment; ADAPT) โดยภายใต้การดำเนินงานนี้ องค์การอาหารและยาจะสามารถให้การรับรองยาปฏิชีวนะและยาต้านเชื้อราใดๆ ที่ทำการศึกษาในกลุ่มตัวอย่างที่เล็กลงกว่าปกติสำหรับการรักษาโรคติดเชื้อที่มีความรุนแรงจนอาจก่อให้เกิดอันตรายแก่ชีวิตของผู้ป่วย ส่วนศูนย์ควบคุมและป้องกันโรค (Centers for Disease Control and Prevention; CDC) จะทำหน้าที่เฝ้าระวังและติดตามการใช้ยาปฏิชีวนะในด้านต่างๆ รวมไปถึงการเกิดการดื้อยาปฏิชีวนะของแบคทีเรีย และตีพิมพ์เผยแพร่ข้อมูลหรือสถานการณ์นั้นให้แก่หน่วยงานอื่นที่เกียวเนื่อง นอกจากนี้ องค์การอาหารและยายังมีหน้าที่ในการกำหนดเกณฑ์ต่างๆที่ใช้ทดสอบความไวของแบคทีเรียต่อยาปฏิชีวนะใดๆ ด้วย อาทิ "เกณฑ์การตีความการทดสอบความไวของจุลินทรีย์" หรือ "ค่าจุดตัดความไวของยา" (breakpoint) และให้ข้อมูลที่ถูกต้องเหล่านี้แก่บุคลากรทางการแพทย์[217][218] ซึ่งการเกิดขึ้นของการดำเนินงานนี้เป็นผลมาจากคำแนะนำของอัลลาน คูเกลล์ (Allan Coukell) ผู้อำนวยการอาวุโสขององค์กรการกุศลพิว (The Pew Charitable Trusts) ที่ได้แสดงความคิดเห็นในประเด็นที่เกี่ยวกับการพัฒนายาปฏิชีวนะชนิดใหม่เพื่อตอบสนองความฉุกเฉินของแบคทีเรียดื้อยาว่า "เพื่อที่จะให้การศึกษาวิจัยทางคลินิกนั้นสามารถทำได้ง่ายมากขึ้น ควรยินยอมให้นักพัฒนายาใช้ข้อมูลและตัวอย่างในการศึกษาทางคลินิกที่น้อยลง และองค์การอาหารและยาก็ต้องแสดงให้เห็นได้แน่ชัดว่าสามารถยอมรับความเสี่ยงที่เพิ่มมากขึ้นเมื่อคิดคำนวณโทษ–ประสิทธิผลที่อาจได้จากยาเหล่านั้น"[219]
ดูเพิ่ม
อ้างอิง
- ↑ "Utilizing antibiotics agents effectively will preserve present day medication". News Ghana. 21 November 2015. สืบค้นเมื่อ 21 November 2015.
- ↑ 2.0 2.1 2.2 2.3 "Antibiotics". NHS. 5 June 2014. สืบค้นเมื่อ 17 January 2015.
- ↑ "Factsheet for experts". European Centre for Disease Prevention and Control. สืบค้นเมื่อ 21 December 2014.
- ↑ "Metronidazole". The American Society of Health-System Pharmacists. สืบค้นเมื่อ 31 July 2015.
- ↑ 5.0 5.1 Chemical Analysis of Antibiotic Residues in Food (PDF). John Wiley & Sons, Inc. 2012. pp. 1–60. ISBN 9781449614591.
- ↑ "American Heritage Dictionary of the English Language" (5th ed.). 2011.
A substance, such as penicillin or erythromycin, produced by or derived from certain microorganisms, including fungi and bacteria, that can destroy or inhibit the growth of other microorganisms, especially bacteria. Antibiotics are widely used in the prevention and treatment of infectious diseases.
- ↑ Mosby's Medical Dictionary (9th ed.). Elsevier. 2013.
1. pertaining to the ability to destroy or interfere with the development of a living organism. 2. an antimicrobial agent, derived from cultures of a microorganism or produced semi-synthetically, used to treat infections
- ↑ "General Background: Antibiotic Agents". Alliance for the Prudent Use of Antibiotics. สืบค้นเมื่อ 21 December 2014.
- ↑ Gualerzi, Claudio O.; Brandi, Letizia; Fabbretti, Attilio; Pon, Cynthia L. (4 December 2013). Antibiotics: Targets, Mechanisms and Resistance. John Wiley & Sons. p. 1. ISBN 9783527333059.
- ↑ "Antibiotics being incorrectly prescribed in Australian nursing homes, prompting superbug fears". ABC Australia. 10 June 2016. สืบค้นเมื่อ 12 June 2016.
- ↑ "UK study warns of threat of antibiotics overuse, lack of new drugs". CCTV America. 19 May 2016. สืบค้นเมื่อ 12 June 2016.
- ↑ "Superbugs could kill more people than cancer, report warns". CBS News. 19 May 2016. สืบค้นเมื่อ 12 June 2016.
- ↑ Brooks, Megan (16 November 2015). "Public Confused About Antibiotic Resistance, WHO Says". Medscape Multispeciality. สืบค้นเมื่อ 21 November 2015.
- ↑ "Antimicrobial resistance: global report on surveillance" (PDF). The World Health Organization. April 2014. ISBN 978 92 4 156474 8. สืบค้นเมื่อ 13 June 2016.
- ↑ 15.0 15.1 15.2 15.3 15.4 Calderon CB, Sabundayo BP (2007). CRC Press (บ.ก.). Antimicrobial Classifications: Drugs for Bugs. In Schwalbe R, Steele-Moore L, Goodwin AC. Antimicrobial Susceptibility Testing Protocols. Taylor & Frances group=. ISBN 978-0-8247-4100-6.
- ↑ 16.0 16.1 16.2 16.3 16.4 Sanjai Saxena, Applied Microbiology
- ↑ Foster W, Raoult A (December 1974). "Early descriptions of antibiosis". J R Coll Gen Pract. 24 (149): 889–94. PMC 2157443. PMID 4618289.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ 18.0 18.1 Landsberg, H (1949). "Prelude to the discovery of penicillin". Isis. 40 (3): 225–7. doi:10.1086/349043.
- ↑ 19.0 19.1 SA Waksman (1947). ""What Is an Antibiotic or an Antibiotic Substance?"". Mycologia. 39 (5): 565–569. doi:10.2307/3755196. JSTOR 3755196. PMID 20264541.
{{cite journal}}: Cite ไม่รู้จักพารามิเตอร์ว่างเปล่า :|month=(help) - ↑ Scholar E. M., Pratt W. B. (2000). The Antimicrobial Drugs. Oxford University Press, USA. p. 3. ISBN 978-0195125290.
- ↑ Davies, Julian; Davies, Dorothy (1 September 2010). "Origins and evolution of antibiotic resistance". Microbiology and molecular biology reviews: MMBR. 74 (3): 417–433. doi:10.1128/MMBR.00016-10. ISSN 1098-5557. PMC 2937522. PMID 20805405.
- ↑ Liddell, Henry George; Scott, Robert (บ.ก.). "βιωτικός". A Greek-English Lexicon – โดยทาง Perseus Project.
- ↑ Liddell, Henry George; Scott, Robert (บ.ก.). "βίωσις". A Greek-English Lexicon – โดยทาง Perseus Project.
- ↑ 24.0 24.1 McGill Student Information: Student Health Service (16 February, 2008). "Antibiotics". McGill University. Canada. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 17 February, 2008. สืบค้นเมื่อ 16 January, 2018.
{{cite web}}: ตรวจสอบค่าวันที่ใน:|accessdate=,|date=และ|archivedate=(help) - ↑ Liddell, Henry George; Scott, Robert (บ.ก.). "βίος". A Greek-English Lexicon – โดยทาง Perseus Project.
- ↑ Liddell, Henry George; Scott, Robert (บ.ก.). "ἀντί". A Greek-English Lexicon – โดยทาง Perseus Project.
- ↑ Liddell, Henry George; Scott, Robert (บ.ก.). "βακτηρία". A Greek-English Lexicon – โดยทาง Perseus Project.
- ↑ bacterial, on Oxford Dictionaries
- ↑ Lindblad WJ (2008). ""Considerations for Determining if a Natural Product Is an Effective Wound-Healing Agent"". International Journal of Lower Extremity Wounds. 7 (2): 75-81. doi:10.1177/1534734608316028. PMID 18483011.
{{cite journal}}: Cite ไม่รู้จักพารามิเตอร์ว่างเปล่า :|month=(help) - ↑ Forrest RD (1982). ""Early history of wound treatment"". J R Soc Med. 75 (3): 198–205. PMC 1437561. PMID 7040656.
{{cite journal}}: ไม่รู้จักพารามิเตอร์|month=ถูกละเว้น (help) - ↑ Wainwright, Milton (1989). ""Moulds in ancient and more recent medicine"". Mycologist. 3 (1): 21–3. doi:10.1016/S0269-915X(89)80010-2.
{{cite journal}}: Cite ไม่รู้จักพารามิเตอร์ว่างเปล่า :|month=(help) - ↑ Kingston W (2008). ""Irish contributions to the origins of antibiotics"". Journal of Medical Science. 177 (2): 87–92. doi:10.1007/s11845-008-0139-x. PMID 18347757.
{{cite journal}}: ไม่รู้จักพารามิเตอร์|month=ถูกละเว้น (help) - ↑ Foster, William; Raoult, Alain (December 1974). "History of Medicine: Early descriptions of antibiosis" (PDF). J R Coll Gen Pract. 24: 889–94. PMC 2157443. PMID 4618289. สืบค้นเมื่อ 31 January 2017.
the first scientific observations of the antagonistic actions of various micro-organisms were made ... by William Roberts of Manchester (1874) and John Tyndall of London (1876).
- ↑ Foster, William; Raoult, Alain (December 1974). "History of Medicine: Early descriptions of antibiosis" (PDF). J R Coll Gen Pract. 24: 889–94. PMC 2157443. PMID 4618289. สืบค้นเมื่อ 31 January 2017.
Both Roberts and Tyndall indicated that the Penicillium molds had some property or had an activity which inhibited bacterial growth.
- ↑ Bucci, Roberto; Gallì, Paola (2012-05-11). "Public Health History Corner Vincenzo Tiberio: a misunderstood researcher". Italian Journal of Public Health (ภาษาอังกฤษ). 8 (4). ISSN 1723-7815.
- ↑ Duchesne, Ernest; Witty, Michael (Translator). "Duchesne's Antagonism between molds and bacteria, an English Colloquial Translation". Amazon.com. สืบค้นเมื่อ 31 January 2017.
{{cite web}}:|first2=มีชื่อเรียกทั่วไป (help) - ↑ 37.0 37.1 Straand, Jørund; Gradmann, Christoph; Simonsen, Gunnar Skov; Lindbæk, Morten (2008). International Encyclopedia of Public Health: Antibiotic Development and Resistance. Academic Press. p. 200. สืบค้นเมื่อ 31 January 2017.
- ↑ 38.0 38.1 "The Nobel Prize in Physiology or Medicine 1945". The Nobel Foundation. สืบค้นเมื่อ 2007-07-28.
- ↑ Tan, Siang Yong; Tatsumura, Yvonne (1 July 2015). "Alexander Fleming (1881–1955): Discoverer of penicillin". Singapore Medical Journal. 56 (7): 366–367. doi:10.11622/smedj.2015105. ISSN 0037-5675. PMC 4520913. PMID 26243971.
- ↑ Fleming A (1980). ""Classics in infectious diseases: on the antibacterial action of cultures of a penicillium, with special reference to their use in the isolation of B. influenzae by Alexander Fleming, Reprinted from the British Journal of Experimental Pathology 10:226–236, 1929"". Rev. Infect. Dis. 2 (1): 129–39. doi:10.1093/clinids/2.1.129. PMC 2048009. PMID 6994200.
{{cite journal}}: Cite ไม่รู้จักพารามิเตอร์ว่างเปล่า :|month=(help) - ↑ Sykes R (2001). ""Penicillin: from discovery to product"". Bull. World Health Organ. 79 (8): 788–9. PMC 2566502. PMID 11545336.
{{cite journal}}: Cite ไม่รู้จักพารามิเตอร์ว่างเปล่า :|month=(help) - ↑ Jones, David S.; Jones, John H. (1 December 2014). "Sir Edward Penley Abraham CBE. 10 June 1913 – 9 May 1999". Biographical Memoirs of Fellows of the Royal Society (ภาษาอังกฤษ). 60: 5–22. doi:10.1098/rsbm.2014.0002. ISSN 0080-4606.
- ↑ HW Florey (1945). ""Use of Micro-organisms for therapeutic purposes"". Br Med J. 2 (4427): 635–642. doi:10.1136/bmj.2.4427.635. PMC 2060276. PMID 20786386.
{{cite journal}}: Cite ไม่รู้จักพารามิเตอร์ว่างเปล่า :|month=(help) - ↑ 44.0 44.1 "René Dubos: unearthing antibiotics" (2006). ""René Dubos: unearthing antibiotics"". J. Exp. Med. 203 (2): 259. doi:10.1084/jem.2032fta. PMC 2118194. PMID 16528813.
{{cite journal}}: Cite ไม่รู้จักพารามิเตอร์ว่างเปล่า :|month=(help) - ↑ Capocci, Mauro (1 January 2014). "Cold drugs. Circulation, production and intelligence of antibiotics in post-WWII years". Medicina Nei Secoli. 26 (2): 401–421. ISSN 0394-9001. PMID 26054208.
- ↑ Limbird LE (2004). ""The receptor concept: a continuing evolution"". Mol. Interv. 4 (6): 326–36. doi:10.1124/mi.4.6.6. PMID 15616162.
{{cite journal}}: ไม่รู้จักพารามิเตอร์|month=ถูกละเว้น (help) - ↑ 47.0 47.1 Bosch F, Rosich L (2008). ""The contributions of Paul Ehrlich to pharmacology: a tribute on the occasion of the centenary of his Nobel Prize"". Pharmacology. 82 (3): 171–9. doi:10.1159/000149583. PMC 2790789. PMID 18679046.
{{cite journal}}: Cite ไม่รู้จักพารามิเตอร์ว่างเปล่า :|month=(help) - ↑ "Salvarsan". Chemical & Engineering News. สืบค้นเมื่อ 2010-02-01.
- ↑ 49.0 49.1 49.2 Frith, John. "Arsenic – the "Poison of Kings" and the "Saviour of Syphilis"". Journal of Military and Veterans' Health. Australasian Military Medicine Association. 21 (4). สืบค้นเมื่อ 31 January 2017.
- ↑ Williams KJ (2009). "The introduction of 'chemotherapy' using arsphenamine – the first magic bullet". J R Soc Med. 102 (8): 343–8. doi:10.1258/jrsm.2009.09k036. PMC 2726818. PMID 19679737.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ 51.0 51.1 Goodman, Louis S.; Gilman, Alfred (1941). The Pharmacological Basis of Therapeutics. New York: Macmillan.
- ↑ The Nobel Prize in Physiology or Medicine 1908, Paul Erlich – Biography
- ↑ Sachachiro Hata – Nomination Database
- ↑ 54.0 54.1 Aminov RI (2010). "A brief history of the antibiotic era: lessons learned and challenges for the future". Frontiers in Microbiology. 1: 134. doi:10.3389/fmicb.2010.00134. PMC 3109405. PMID 21687759.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ "Physiology or Medicine 1939 – Presentation Speech". Nobel Foundation. สืบค้นเมื่อ 14 January 2015.
- ↑ Wright, Peter M.; Seiple, Ian B.; Myers, Andrew G. (18 August 2014). "The evolving role of chemical synthesis in antibacterial drug discovery". Angewandte Chemie (International Ed. in English). 53 (34): 8840–8869. doi:10.1002/anie.201310843. ISSN 1521-3773. PMC 4536949. PMID 24990531.
- ↑ Aminov, Rustam I. (1 January 2010). "A brief history of the antibiotic era: lessons learned and challenges for the future". Frontiers in Microbiology. 1: 134. doi:10.3389/fmicb.2010.00134. ISSN 1664-302X. PMC 3109405. PMID 21687759.
- ↑ Reynolds PE (1989). "Structure, biochemistry and mechanism of action of glycopeptide antibiotics". Eur J Clin Microbiol Infect Dis. 8 (11): 943-50. PMID 2532132.
{{cite journal}}: ไม่รู้จักพารามิเตอร์|month=ถูกละเว้น (help) - ↑ 59.0 59.1 59.2 Antibiotics Simplified. Jones & Bartlett Publishers. 2011. pp. 15–17. ISBN 9781449614591.
- ↑ 60.0 60.1 60.2 60.3 Leekha, Surbhi; Terrell, Christine L.; Edson, Randall S. (1 February 2011). "General principles of antimicrobial therapy". Mayo Clinic Proceedings. 86 (2): 156–167. doi:10.4065/mcp.2010.0639. ISSN 1942-5546. PMC 3031442. PMID 21282489.
- ↑ Rollins, KE; Varadhan, KK; Neal, KR; Lobo, DN (19 May 2016). "Antibiotics Versus Appendicectomy for the Treatment of Uncomplicated Acute Appendicitis: An Updated Meta-Analysis of Randomised Controlled Trials". World journal of surgery. 40: 2305–2318. doi:10.1007/s00268-016-3561-7. PMID 27199000.
- ↑ Flowers, Christopher R.; Seidenfeld, Jerome; Bow, Eric J.; Karten, Clare; Gleason, Charise; Hawley, Douglas K.; Kuderer, Nicole M.; Langston, Amelia A.; Marr, Kieren A. (20 February 2013). "Antimicrobial prophylaxis and outpatient management of fever and neutropenia in adults treated for malignancy: American Society of Clinical Oncology clinical practice guideline". Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology. 31 (6): 794–810. doi:10.1200/JCO.2012.45.8661. ISSN 1527-7755. PMID 23319691.
- ↑ Bow, Eric J. (1 July 2013). "Infection in neutropenic patients with cancer". Critical Care Clinics. 29 (3): 411–441. doi:10.1016/j.ccc.2013.03.002. ISSN 1557-8232. PMID 23830647.
- ↑ Pangilinan, Ronald; Tice, Alan; Tillotson, Glenn (1 October 2009). "Topical antibiotic treatment for uncomplicated skin and skin structure infections: review of the literature". Expert Review of Anti-Infective Therapy. 7 (8): 957–965. doi:10.1586/eri.09.74. ISSN 1744-8336. PMID 19803705.
- ↑ 65.0 65.1 Lipsky, Benjamin A.; Hoey, Christopher (15 November 2009). "Topical antimicrobial therapy for treating chronic wounds". Clinical Infectious Diseases. 49 (10): 1541–1549. doi:10.1086/644732. ISSN 1537-6591. PMID 19842981.
- ↑ Heal, Clare F; Banks, Jennifer L; Lepper, Phoebe D; Kontopantelis, Evangelos; van Driel, Mieke L. "Topical antibiotics for preventing surgical site infection in wounds healing by primary intention". Cochrane Database of Systematic Reviews 2016 (11). doi:10.1002/14651858.CD011426.pub2.
- ↑ 67.0 67.1 67.2 Slama TG, Amin A, Brunton SA; และคณะ (July 20015). "A clinician's guide to the appropriate and accurate use of antibiotics: the Council for Appropriate and Rational Antibiotic Therapy (CARAT) criteria". Am J Med. 118 Suppl 7A (7): 1S–6S. doi:10.1016/j.amjmed.2005.05.007. PMID 15993671.
{{cite journal}}: ตรวจสอบค่าวันที่ใน:|date=(help); ใช้ et al. อย่างชัดเจน ใน|author=(help)CS1 maint: multiple names: authors list (ลิงก์) - ↑ "Antibiotics and Selective Toxicity – Boundless Open Textbook". Boundless. สืบค้นเมื่อ 12 February 2016.
- ↑ "Antibiotics – Side effects". NHS Choices. National Health Service (NHS), UK. 6 May 2014. สืบค้นเมื่อ 6 February 2016.
- ↑ "Antibiotic-Associated Diarrhea – All you should know". สืบค้นเมื่อ 28 December 2014.
- ↑ Pirotta MV, Garland SM (2006). ""Genital Candida species detected in samples from women in Melbourne, Australia, before and after treatment with antibiotics"". J Clin Microbiol. 44 (9): 3213–3217. doi:10.1128/JCM.00218-06. PMC 1594690. PMID 16954250.
- ↑ Lewis, Trevor; Cook, Jill (1 January 2014). "Fluoroquinolones and Tendinopathy: A Guide for Athletes and Sports Clinicians and a Systematic Review of the Literature". Journal of Athletic Training. 49 (3): 422–427. doi:10.4085/1062-6050-49.2.09. ISSN 1062-6050. PMC 4080593. PMID 24762232.
- ↑ Ray, Katrina (September 2012). "Adding weight to the microbiota's role in obesity—exposure to antibiotics early in life can lead to increased adiposity". Nature Reviews Endocrinology. 8: 623. doi:10.1038/nrendo.2012.173.
- ↑ 74.0 74.1 Jess, Tine (December 2014). "Microbiota, Antibiotics, and Obesity". The New England Journal of Medicine. 371: 2526–2528. doi:10.1056/NEJMcibr1409799.
- ↑ Cho, Ilseung; และคณะ (August 2012). "Antibiotics in early life alter the murine colonic microbiome and adiposity". Nature. 488: 621–6. doi:10.1038/nature11400. PMC 3553221. PMID 22914093.
- ↑ 76.0 76.1 Cox, Laura; และคณะ (14 August 2014). "Altering the intestinal microbiota during a critical developmental window has lasting metabolic consequences". Cell. 158 (4): 705–21. doi:10.1016/j.cell.2014.05.052. PMC 4134513. PMID 25126780.
- ↑ Trasande, L.; Blustein, J.; Liu, M.; Corwin, E.; Cox, L. M.; Blaser, M. J. (1 January 2013). "Infant antibiotic exposures and early-life body mass". International Journal of Obesity (ภาษาอังกฤษ). 37 (1): 16–23. doi:10.1038/ijo.2012.132. ISSN 0307-0565. PMC 3798029. PMID 22907693.
- ↑ Thorpe, Karen; Staton, Sally; Sawyer, Emily; Pattinson, Cassandra; Haden, Catherine; Smith, Simon (1 July 2015). "Napping, development and health from 0 to 5 years: a systematic review". Archives of Disease in Childhood (ภาษาอังกฤษ). 100 (7): 615–622. doi:10.1136/archdischild-2014-307241. PMID 25691291.
- ↑ 79.0 79.1 79.2 79.3 Anderson, Keri C.; Schwartz, Michael D.; Lieu, Siam O. (1 January 2013). "Antibiotics and OC effectiveness". JAAPA: official journal of the American Academy of Physician Assistants. 26 (1): 11. doi:10.1097/01720610-201301000-00002. ISSN 1547-1896. PMID 23355994.
- ↑ 80.0 80.1 80.2 Weaver K, Glasier A (1999). "Interaction between broad-spectrum antibiotics and the combined oral contraceptive pill. A literature review". Contraception. 59 (2): 71–8. doi:10.1016/S0010-7824(99)00009-8. PMID 10361620.
{{cite journal}}: ไม่รู้จักพารามิเตอร์|month=ถูกละเว้น (help) - ↑ Weisberg E (1999). "Interactions between oral contraceptives and antifungals/antibacterials. Is contraceptive failure the result?". Clin Pharmacokinet. 36 (5): 309–13. doi:10.2165/00003088-199936050-00001. PMID 10384856.
{{cite journal}}: ไม่รู้จักพารามิเตอร์|month=ถูกละเว้น (help) - ↑ Hassan T (1987). "Pharmacologic considerations for patients taking oral contraceptives". Conn Dent Stud J. 7: 7-8. PMID 3155374.
{{cite journal}}: ไม่รู้จักพารามิเตอร์|month=ถูกละเว้น (help) - ↑ Orme ML, Back DJ (1990). ""Factors affecting the enterohepatic circulation of oral contraceptive steroids"". Am. J. Obstet. Gynecol. 163 (6 Pt 2): 2146–52. doi:10.1016/0002-9378(90)90555-L. PMID 2256523.
{{cite journal}}: ตรวจสอบค่าวันที่ใน:|archivedate=(help); ไม่รู้จักพารามิเตอร์|month=ถูกละเว้น (help) - ↑ Lwanga, J; Mears, A; Bingham, J S; Bradbeer, C S (2008). "Do antibiotics and alcohol mix? The beliefs of genitourinary clinic attendees". BMJ. 337: a2885. doi:10.1136/bmj.a2885.
{{cite journal}}: Cite ไม่รู้จักพารามิเตอร์ว่างเปล่า :|month=(help)CS1 maint: multiple names: authors list (ลิงก์) - ↑ James M. Steckelberg (18 November, 2010). "What are the effects of drinking alcohol while taking antibiotics?". Mayo Foundation for Medical Education and Research. สืบค้นเมื่อ 16 January, 2018.
{{cite web}}: ตรวจสอบค่าวันที่ใน:|accessdate=และ|date=(help) - ↑ 86.0 86.1 NHS Choices (8 May, 2015). "Can I drink alcohol while taking antibiotics?". National Health Service. สืบค้นเมื่อ 16 January, 2018.
{{cite web}}: ตรวจสอบค่าวันที่ใน:|accessdate=และ|date=(help) - ↑ Moore, Alison A.; Whiteman, Elizabeth J.; Ward, Katherine T. (1 March 2007). "Risks of Combined Alcohol-Medication Use in Older Adults". The American journal of geriatric pharmacotherapy. 5 (1): 64–74. doi:10.1016/j.amjopharm.2007.03.006. ISSN 1543-5946. PMC 4063202. PMID 17608249.
- ↑ Stockley, IH (2002). Stockley's Drug Interactions (6th ed.). London: Pharmaceutical Press.
- ↑ 89.0 89.1 89.2 Pankey GA, Sabath LD (2004). "Clinical relevance of bacteriostatic versus bactericidal mechanisms of action in the treatment of Gram-positive bacterial infections". Clin Infect Dis. 38 (6): 864–870. doi:10.1086/381972. PMID 14999632.
{{cite journal}}: ไม่รู้จักพารามิเตอร์|month=ถูกละเว้น (help) - ↑ Mascio CT, Alder JD, Silverman JA (2007). ""Bactericidal action of daptomycin against stationary-phase and nondividing Staphylococcus aureus cells"". Antimicrob. Agents Chemother. p. 4255–60. doi:10.1128/AAC.00824-07. PMC 2167999. PMID 17923487.
{{cite web}}: ไม่รู้จักพารามิเตอร์|month=ถูกละเว้น (help)CS1 maint: multiple names: authors list (ลิงก์) - ↑ Pelczar MJ, Chan EC, Krieg NR (2010). "Host-Parasite Interaction; Nonspecific Host Resistance". Microbiology Concepts and Applications (6th ed.). New York: McGraw-Hill. pp. 478–479.
{{cite book}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Rhee KY, Gardiner DF (2004). ""Clinical relevance of bacteriostatic versus bactericidal activity in the treatment of gram-positive bacterial infections"". Clin. Infect. Dis. p. 755-6. doi:10.1086/422881. PMID 15356797.
{{cite web}}: ไม่รู้จักพารามิเตอร์|month=ถูกละเว้น (help) - ↑ Wiegand I, Hilpert K, Hancock RE (2008). ""Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC)of antimicrobial substances"". Nature Protocols. p. 163-75. doi:10.1038/nprot.2007.521. PMID 18274517.
{{cite web}}: ไม่รู้จักพารามิเตอร์|month=ถูกละเว้น (help)CS1 maint: multiple names: authors list (ลิงก์) - ↑ Dalhoff A, Ambrose PG, Mouton JW (August 2009). "A long journey from minimum inhibitory concentration testing to clinically predictive breakpoints: deterministic and probabilistic approaches in deriving breakpoints". Infection. 37 (4): 296–305. doi:10.1007/s15010-009-7108-9. PMID 19629383.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ 95.0 95.1 95.2 95.3 Ocampo, Paolo S.; Lázár, Viktória; Papp, Balázs; Arnoldini, Markus; Abel zur Wiesch, Pia; Busa-Fekete, Róbert; Fekete, Gergely; Pál, Csaba; Ackermann, Martin (1 August 2014). "Antagonism between bacteriostatic and bactericidal antibiotics is prevalent". Antimicrobial Agents and Chemotherapy. 58 (8): 4573–4582. doi:10.1128/AAC.02463-14. ISSN 1098-6596. PMC 4135978. PMID 24867991.
- ↑ 96.0 96.1 Bollenbach, Tobias (1 October 2015). "Antimicrobial interactions: mechanisms and implications for drug discovery and resistance evolution". Current Opinion in Microbiology. 27: 1–9. doi:10.1016/j.mib.2015.05.008. ISSN 1879-0364. PMID 26042389.
- ↑ "antagonism". สืบค้นเมื่อ 25 August 2014.
- ↑ Finberg RW, Moellering RC, Tally FP; และคณะ (2004). ""The importance of bactericidal drugs: future directions in infectious disease"". Clin. Infect. Dis. 39 (9): 1314–20. doi:10.1086/425009. PMID 15494908.
{{cite journal}}: ใช้ et al. อย่างชัดเจน ใน|author=(help); ไม่รู้จักพารามิเตอร์|month=ถูกละเว้น (help)CS1 maint: multiple names: authors list (ลิงก์) - ↑ Cunha BA. Antibiotic Essentials 2009. Jones & Bartlett Learning, ISBN 978-0-7637-7219-2 p. 180, for example.
- ↑ Srivastava A, Talaue M, Liu S, Degen D, Ebright RY, Sineva E, Chakraborty A, Druzhinin SY, Chatterjee S, Mukhopadhyay J, Ebright YW, Zozula A, Shen J, Sengupta S, Niedfeldt RR, Xin C, Kaneko T, Irschik H, Jansen R, Donadio S, Connell N, Ebright RH (2011). "New target for inhibition of bacterial RNA polymerase: 'switch region'". Curr. Opin. Microbiol. 14 (5): 532–43. doi:10.1016/j.mib.2011.07.030. PMC 3196380. PMID 21862392.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ 101.0 101.1 101.2 101.3 For common Uses and possible side effects reference is: Robert Berkow (ed.) El manual de Merck|The Merck Manual of Medical Information - Home Edition. Pocket (septiembre 1999), ISBN 0-671-02727-1.
- ↑ MedlinePlus (January, 2003). "Inyección de Sulfato de amikacina". Enciclopedia médica en español. สืบค้นเมื่อ 2 September.
{{cite web}}: ตรวจสอบค่าวันที่ใน:|accessdate=และ|year=(help) - ↑ 103.0 103.1 103.2 Townsend 2005, p. 275
- ↑ Mingeot-Leclercq MP, Glupczynski Y, Tulkens PM (1999). "Aminoglycosides: activity and resistance". Antimicrob. Agents Chemother. 43 (4): 727–37. PMC 89199. PMID 10103173.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Supko JG, Hickman RL, Grever MR y Malspeis L. (1995). "Preclinical pharmacologic evaluation of geldanamycin as an antitumor agent". Cancer Chemother Pharmacol. 36 (4): 305-15. PMID 7628050. สืบค้นเมื่อ 4 April, 2011.
{{cite journal}}: ตรวจสอบค่าวันที่ใน:|accessdate=(help)CS1 maint: multiple names: authors list (ลิงก์) - ↑ Blanco AN, Habib A, Levy-Toledano S, Maclouf J (1995). "Participación de las tirosin-quinasas en la inducción de la ciclooxigenasa-2 en células endoteliales humanas". Revista Medicina. 55 (5): 509. ISSN 0025-7680. สืบค้นเมื่อ 4 de abril de 2011.
{{cite journal}}: ตรวจสอบค่าวันที่ใน:|accessdate=(help)CS1 maint: multiple names: authors list (ลิงก์) - ↑ Aljitawi OS, Krishnan K, Curtis BR, Bougie DW, Aster RH (May, 2003). "Serologically documented loracarbef (Lorabid) -induced immune thrombocytopenia". Am J Hematol. 73 (1): 41-3. สืบค้นเมื่อ 2 September, 2008.
{{cite journal}}: ตรวจสอบค่าวันที่ใน:|accessdate=และ|year=(help)CS1 maint: multiple names: authors list (ลิงก์) - ↑ 108.0 108.1 108.2 108.3 108.4 108.5 Townsend 2005, p. 274
- ↑ Enciclopedia Microsoft® Encarta® Online, บ.ก. (2008). "Antibiótico". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 5 de diciembre de 2008. สืบค้นเมื่อ 2 September, 2008.
{{cite web}}: ตรวจสอบค่าวันที่ใน:|accessdate=และ|archivedate=(help) - ↑
Splete; Kerri, Heidi (March, 2006). "Liver toxicity reported with Ketek". Internal Medicine News.
{{cite journal}}:|first3=ไม่มี|last3=(help); ตรวจสอบค่าวันที่ใน:|year=(help) - ↑ E Navas Elorza (2002). "Tetraciclinas, fenicoles, lincosamidas, polimixinas, espectinomicina, fosfomicina". Medicine. 8 (70): 3763-3770.
- ↑ Celaya Rodríguez M, Moreno Navarrete J. (2001). "Estudio bacteriológico y determinación de la sensibilidad a 21 antibióticos, en una población de pacientes atendidos en el Hospital General de México durante el año 1999" (PDF). Enf. Infec. y Micro. (ภาษาภาษาสเปน). 21 (4): 129-144.
{{cite journal}}: CS1 maint: unrecognized language (ลิงก์) - ↑ K. John Stone and Jack L. Strominger (1971). "Mechanism of Action of Bacitracin: Complexation with Metal Ion and C55-Isoprenyl Pyrophosphate]". PNAS. 68 (12): 3223-3227. สืบค้นเมื่อ 29 April, 2011.
{{cite journal}}: ตรวจสอบค่าวันที่ใน:|accessdate=(help) - ↑ Life-Extension-Drugs.com. "Doxycycline". สืบค้นเมื่อ 29 April, 2011.
{{cite web}}: ตรวจสอบค่าวันที่ใน:|accessdate=(help) - ↑ Rich M, Ritterhoff R, Hoffmann R (December, 1950). "A fatal case of aplastic anemia following chloramphenicol (chloromycetin) therapy". Ann Intern Med. 33 (6): 1459–67. PMID 14790529.
{{cite journal}}: ตรวจสอบค่าวันที่ใน:|year=(help)CS1 maint: multiple names: authors list (ลิงก์) - ↑ Daum RS (2007). "Clinical practice. Skin and soft-tissue infections caused by methicillin-resistant Staphylococcus aureus". N Engl J Med. 357 (4): 380–90. doi:10.1056/NEJMcp070747. PMID 17652653.
- ↑ Thomas C, Stevenson M, Riley TV (2003). "Antibiotics and hospital-acquired Clostridium difficile-associated diarrhoea: a systematic review" (PDF). J Antimicrob Chemother. 51 (6): 1339–50. doi:10.1093/jac/dkg254. PMID 12746372.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Merck & Co., บ.ก. (November, 2005). "Lincosamides, Oxazolidinones, and Streptogramins". Merck Manual of Diagnosis and Therapy. สืบค้นเมื่อ 1 December, 2007.
{{cite web}}: ตรวจสอบค่าวันที่ใน:|accessdate=และ|year=(help) - ↑ Yendapally R, Lee RE (2008). (08) 00082-6 "Design, synthesis, and evaluation of novel ethambutol analogues". Bioorg. Med. Chem. Lett. 18 (5): 1607–11. doi:10.1016/j.bmcl.2008.01.065. PMC 2276401. PMID 18242089.
{{cite journal}}: ตรวจสอบค่า|url=(help) - ↑ Lim SA (2006). "Ethambutol-associated optic neuropathy" (PDF). Ann. Acad. Med. Singap. 35 (4): 274–8. PMID 16710500.
- ↑ Swaney SM, Aoki H, Ganoza MC, Shinabarger DL (1998). "The oxazolidinone linezolid inhibits initiation of protein synthesis in bacteria" (PDF). Antimicrobial Agents and Chemotherapy. 42 (12): 3251–5. ISSN 0066-4804. PMC 106030. PMID 9835522.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Ament PW, Jamshed N, Horne JP (2002). "Linezolid: its role in the treatment of gram-positive, drug-resistant bacterial infections". American Family Physician. 65 (4): 663–70. ISSN 0002-838X. PMID 11871684.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ "Flagyl, Flagyl ER (metronidazole) dosing, indications, interactions, adverse effects, and more". Medscape Reference. WebMD. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 7 April 2014. สืบค้นเมื่อ 3 April 2014.
{{cite web}}: ไม่รู้จักพารามิเตอร์|deadurl=ถูกละเว้น แนะนำ (|url-status=) (help) - ↑ 124.0 124.1 "Macrobid Drug Label" (PDF). FDA. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 21 April 2014. สืบค้นเมื่อ 21 April 2014.
{{cite web}}: ไม่รู้จักพารามิเตอร์|deadurl=ถูกละเว้น แนะนำ (|url-status=) (help) - ↑ Jick, S S; Jick, H; Walker, A M; Hunter, J R (1989-09-01). "Hospitalizations for pulmonary reactions following nitrofurantoin use". Chest. 96 (3): 512–515. doi:10.1378/chest.96.3.512. ISSN 0012-3692.
- ↑ Huttner, Angela; Verhaegh, Els M.; Harbarth, Stephan; Muller, Anouk E.; Theuretzbacher, Ursula; Mouton, Johan W. (2015-09-01). "Nitrofurantoin revisited: a systematic review and meta-analysis of controlled trials". Journal of Antimicrobial Chemotherapy (ภาษาอังกฤษ). 70 (9): 2456–2464. doi:10.1093/jac/dkv147. ISSN 0305-7453. PMID 26066581.
- ↑ Tu Y, McCalla DR (1975). "Effect of activated nitrofurans on DNA,". Biochim Biophys Acta. 402: 142–49.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ J. Wang, S.M. Soisson, K .Young, S.B. Singh etc (2006). Nature. 441: 358-61.
{{cite journal}}:|title=ไม่มีหรือว่างเปล่า (help)CS1 maint: multiple names: authors list (ลิงก์) - ↑ D T. Manallack, I T. Crosby, Y. Khakham and B. Capuano (2008). "Current Medicinal Chemistry". 15: 705-710.
{{cite journal}}: Cite journal ต้องการ|journal=(help)CS1 maint: multiple names: authors list (ลิงก์) - ↑ 130.0 130.1 "Pyrazinamide". The American Society of Health-System Pharmacists. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 20 December 2016. สืบค้นเมื่อ 8 December 2016.
{{cite web}}: ไม่รู้จักพารามิเตอร์|deadurl=ถูกละเว้น แนะนำ (|url-status=) (help) - ↑ East and Central African/Medical Research Council Fifth Collaborative Study (1983). "Controlled clinical trial of 4 short-course regimens of chemotherapy (three 6-month and one 9-month) for pulmonary tuberculosis". Tubercle. 64 (3): 153–166. doi:10.1016/0041-3879(83)90011-9. PMID 6356538.
- ↑ British Thoracic Society (1984). "A controlled trial of 6 months chemotherapy in pulmonary tuberculosis, final report: results during the 36 months after the end of chemotherapy and beyond". Br J Dis Chest. 78 (4): 330–336. doi:10.1016/0007-0971(84)90165-7. PMID 6386028.
- ↑ Yee D และคณะ (2003). "Incidence of serious side effects from first-line antituberculosis drugs among patients treated for active tuberculosis". Am J Respir Crit Care Med. 167 (11): 1472–7. doi:10.1164/rccm.200206-626OC. PMID 12569078.
{{cite journal}}: ใช้ et al. อย่างชัดเจน ใน|authors=(help)CS1 maint: uses authors parameter (ลิงก์) - ↑ Zimhony O, Cox JS, Welch JT, Vilchèze C, Jacobs WR (2000). "Pyrazinamide inhibits the eukaryotic-like fatty acid synthetase I (FASI) of Mycobacterium tuberculosis". Nature Medicine. 6 (9): 1043–47. doi:10.1038/79558. PMID 10973326. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (abstract)เมื่อ 2009-02-28.
{{cite journal}}: ไม่รู้จักพารามิเตอร์|deadurl=ถูกละเว้น แนะนำ (|url-status=) (help)CS1 maint: uses authors parameter (ลิงก์) - ↑ 135.0 135.1 "Quinupristin-dalfopristin: a new antibiotic for severe gram-positive infections". Am Fam Physician. 64 (11): 1863–6. December, 2001. PMID 11764864.
{{cite journal}}: ตรวจสอบค่าวันที่ใน:|date=(help) - ↑ "Quinupristin/dalfopristin: a review of its use in the management of serious gram-positive infections". Drugs. 58 (6): 1061–97. December 1999. doi:10.2165/00003495-199958060-00008. PMID 10651391.
- ↑ Allington, DR; Rivey, MP. (Jan 2001). "Quinupristin/dalfopristin: a therapeutic review". Clin Ther. 23 (1): 24–44. doi:10.1016/S0149-2918(01)80028-X. PMID 11219478.
- ↑ 138.0 138.1 William Barry Hugo, Stephen P. Denyer, Norman A. Hodges, Sean P. Gorman (2004). Hugo and Russell's pharmaceutical microbiology (7, illustrated ed.). Wiley-Blackwell. p. 212. ISBN 978-0-632-06467-0.
{{cite book}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 139.0 139.1 139.2 "Rifampin". The American Society of Health-System Pharmacists. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2015-09-07. สืบค้นเมื่อ Aug 1, 2015.
{{cite web}}: ไม่รู้จักพารามิเตอร์|deadurl=ถูกละเว้น แนะนำ (|url-status=) (help) - ↑ Calvori, C.; Frontali, L.; Leoni, L.; Tecce, G. (1965). "Effect of rifamycin on protein synthesis". Nature. 207 (995): 417–8. doi:10.1038/207417a0. PMID 4957347.
- ↑ 141.0 141.1 141.2 Ebel, K., Koehler, H., Gamer, A. O., & Jäckh, R. (2002). Imidazole and Derivatives. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH. doi:10.1002/14356007.a13_661.
{{cite book}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Edwards, David I. (1993). "Nitroimidazole drugs - action and resistance mechanisms. I. Mechanism of action". Journal of Antimicrobial Chemotherapy. 31: 9-20. doi:10.1093/jac/31.1.9.
- ↑ 143.0 143.1 von Nussbaum, Franz; Brands, Michael; Hinzen, Berthold; Weigand, Stefan; Häbich, Dieter (4 August 2006). "Antibacterial Natural Products in Medicinal Chemistry—Exodus or Revival?". Angewandte Chemie International Edition (ภาษาอังกฤษ). 45 (31): 5072–5129. doi:10.1002/anie.200600350. ISSN 1521-3773. PMID 16881035. สืบค้นเมื่อ 3 August 2016.
- ↑ Dougherty TJ; Pucci MJ (18 December 2011). Antibiotic Discovery and Development. Springer. p. 800.
- ↑ 145.0 145.1 Doug Gurian-Sherman (2008). Union of Concerned Scientists (บ.ก.). CAFOs Uncovered: The Untold Costs of Confined Animal Feeding Operations (PDF) (ภาษาEnglish). Cambridge, MA.
{{cite book}}: ไม่รู้จักพารามิเตอร์|month=ถูกละเว้น (help)CS1 maint: unrecognized language (ลิงก์) - ↑ Shu-Jen Chiang (2004). "Strain improvement for fermentation and biocatalysis processes by genetic engineering technology". Journal of Industrial Microbiology and Biotechnology. 31 (3): 99-108. doi:10.1007/s10295-004-0131-z.
- ↑ 147.0 147.1 147.2 Karen Miller, Dr. Tony Phillips (2002). NASA: Desarrollo de Productos Espaciales - Centro Marshall para Vuelos Espaciales (บ.ก.). "Antibióticos del Espacio". สืบค้นเมื่อ 4 September, 2008.
{{cite web}}: ตรวจสอบค่าวันที่ใน:|accessdate=(help); ไม่รู้จักพารามิเตอร์|month=ถูกละเว้น (help) - ↑ Fresno Chavez, Caridad (2001). "El diseño de nuevos antibióticos" (PDF). Revista Cubana de Medicina General Integral (ภาษาSpanish). 17 (2): 196-199. ISSN 0864-2125.
{{cite journal}}: CS1 maint: unrecognized language (ลิงก์) - ↑ Allen I. Laskin, Geoffrey M. Gadd, Sima Sariaslani (2008). Academic Press (บ.ก.). Advances in Applied Microbiology (ภาษาEnglish). ISBN 0-444-53191-2.
{{cite book}}: CS1 maint: multiple names: authors list (ลิงก์) CS1 maint: unrecognized language (ลิงก์) - ↑ Bhattacharyya, Barun K., PAL, Sushil C. and SEN, Sukanta K. (1998). "Antibiotic production by Streptomyces hygroscopicus d1.5: Cultural effect". Revista de Microbiologia. 29 (3). doi:10.1590/S0001-37141998000300003. ISSN 0001-3714.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Guojun Wang, Takeshi Hosaka y Kozo Ochi (2008). "Dramatic Activation of Antibiotic Production in Streptomyces coelicolor by Cumulative Drug-Resistance Mutations" (PDF). Applied and Environmental Microbiology. 74 (9): 2834-2840. doi:10.1128/AEM.02800-07.
- ↑ Strohl W. R. (1997). Biotechnology of Antibiotics. Informa Health Care (ภาษาEnglish). ISBN 0-8247-9867-8.
{{cite book}}: CS1 maint: unrecognized language (ลิงก์) - ↑ Mahajan, GB (2012). "Antibacterial agents from actinomycetes - a review". Frontiers in Bioscience. 4: 240–53. doi:10.2741/e373.
- ↑ Nisha AR (2008). "Antibiotic Residues - A Global Health Hazard" (PDF). Veterinary World. 1 (12): 375-377.
{{cite journal}}: Cite ไม่รู้จักพารามิเตอร์ว่างเปล่า s:|títulotrad=และ|en=(help); ไม่รู้จักพารามิเตอร์|month=ถูกละเว้น (help) - ↑ Mellon, M et ál. (2001). Union of Concerned Scientists (บ.ก.). Hogging It!: Estimates of Antimicrobial Abuse in Livestock (PDF) (1ª ed.). Cambridge, MA.
- ↑ North Carolina State University Cooperative Extension, Department of Food Science. "Preventing Antibiotic Residues In Milk" (ภาษาEnglish). คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 27 de agosto de 2011. สืบค้นเมื่อ 16 May, 2011.
{{cite web}}: ตรวจสอบค่าวันที่ใน:|accessdate=และ|archivedate=(help)CS1 maint: unrecognized language (ลิงก์) - ↑ Centers for Disease Control and Prevention, United States Department of Health and Human Services. "Concentrated animal feeding operations".
- ↑ Levy SB (1994). ""Balancing the drug-resistance equation"". Trends Microbiol. 2 (10): 341–2. doi:10.1016/0966-842X(94)90607-6. PMID 7850197.
{{cite journal}}: ไม่รู้จักพารามิเตอร์|month=ถูกละเว้น (help) - ↑ Luria SE, Delbrück M (1943). ""Mutations of Bacteria from Virus Sensitivity to Virus Resistance"". Genetics. 28 (6): 491–511. PMC 1209226. PMID 17247100. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 18 November, 2010.
{{cite journal}}: ตรวจสอบค่าวันที่ใน:|archivedate=(help); ไม่รู้จักพารามิเตอร์|month=ถูกละเว้น (help) - ↑ 160.0 160.1 Pearson, Carol (28 February, 2007). ""Antibiotic Resistance Fast-Growing Problem Worldwide"". Voice of America (ภาษาEnglish). คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 29 December, 2008. สืบค้นเมื่อ 8 February.
{{cite web}}: ตรวจสอบค่าวันที่ใน:|accessdate=,|date=และ|archivedate=(help)CS1 maint: unrecognized language (ลิงก์) - ↑ Topp E, Chapman R, Devers-Lamrani M, Hartmann A, Marti R, Martin-Laurent F, Sabourin L, Scott A, Sumarah M (2013). "Accelerated Biodegradation of Veterinary Antibiotics in Agricultural Soil following Long-Term Exposure, and Isolation of a Sulfamethazine-degrading sp". J. Environ. Qual. 42 (1): 173–8. doi:10.2134/jeq2012.0162. PMID 23673752.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ 162.0 162.1 162.2 Witte W (2004). ""International dissemination of antibiotic resistant strains of bacterial pathogens"". Infect. Genet. Evol. 4 (3): 187–91. doi:10.1016/j.meegid.2003.12.005. PMID 15450197.
{{cite journal}}: ไม่รู้จักพารามิเตอร์|month=ถูกละเว้น (help) - ↑ Dyer, Betsey Dexter (2003). "Chapter 9, Pathogens". A Field Guide To Bacteria. Cornell University Press. ISBN 978-0-8014-8854-2.
- ↑ D'Costa VM, King CE, Kalan L, Morar M, Sung WW, Schwarz C, Froese D, Zazula G, Calmels F, Debruyne R, Golding GB, Poinar HN, Wright GD (2011). ""Antibiotic resistance is ancient"". Nature. 477 (7365): 457–61. doi:10.1038/nature10388. PMID 21881561.
{{cite journal}}: ไม่รู้จักพารามิเตอร์|month=ถูกละเว้น (help)CS1 maint: multiple names: authors list (ลิงก์) - ↑ Gladki A, Kaczanowski S, Szczesny P, Zielenkiewicz P (2013). ""The evolutionary rate of antibacterial drug targets"". BMC Bioinformatics. 14 (1): 36. doi:10.1186/1471-2105-14-36. PMC 3598507. PMID 23374913.
{{cite journal}}: ไม่รู้จักพารามิเตอร์|month=ถูกละเว้น (help)CS1 maint: multiple names: authors list (ลิงก์) - ↑ 166.0 166.1 Alekshun MN, Levy SB (2007). ""Molecular mechanisms of antibacterial multidrug resistance"". Cell. 128 (6): 1037–50. doi:10.1016/j.cell.2007.03.004. PMID 17382878.
{{cite journal}}: ไม่รู้จักพารามิเตอร์|month=ถูกละเว้น (help) - ↑ Pawlowski, Andrew C; Wang, Wenliang; Koteva, Kalinka; Barton, Hazel; McArthur, Andrew G; Wright, Gerard D (December 2016). "A diverse intrinsic antibiotic resistome from a cave bacterium". Nature Communications. 7: 1–10. doi:10.1038/ncomms13803. PMID 27929110.
- ↑ Marshall CG, Lessard IA, Park I, Wright GD (1998). ""Glycopeptide antibiotic resistance genes in glycopeptide-producing organisms"". Antimicrob. Agents Chemother. 42 (9): 2215–20. PMC 105782. PMID 9736537. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 18 November, 2010.
{{cite journal}}: ตรวจสอบค่าวันที่ใน:|archivedate=(help); ไม่รู้จักพารามิเตอร์|month=ถูกละเว้น (help)CS1 maint: multiple names: authors list (ลิงก์) - ↑ Nikaido H (2009). ""Multidrug Resistance in Bacteria"". Annu. Rev. Biochem. 78 (1): 119–46. doi:10.1146/annurev.biochem.78.082907.145923. PMC 2839888. PMID 19231985.
{{cite journal}}: ไม่รู้จักพารามิเตอร์|month=ถูกละเว้น (help) - ↑ 170.0 170.1 170.2 Baker-Austin C, Wright MS, Stepanauskas R, McArthur JV (2006). ""Co-selection of antibiotic and metal resistance"". Trends Microbiol. 14 (4): 176–82. doi:10.1016/j.tim.2006.02.006. PMID 16537105.
{{cite journal}}: ไม่รู้จักพารามิเตอร์|month=ถูกละเว้น (help)CS1 maint: multiple names: authors list (ลิงก์) - ↑ "Health ministers to accelerate efforts against drug-resistant TB". World Health Organization (WHO).
- ↑ Boseley, Sarah (12 August, 2010). ""Are you ready for a world without antibiotics?"". The Guardian (ภาษาEnglish). London. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 18 November, 2010. สืบค้นเมื่อ 8 February, 2018.
{{cite web}}: ตรวจสอบค่าวันที่ใน:|accessdate=,|date=และ|archivedate=(help)CS1 maint: unrecognized language (ลิงก์) - ↑ Health Protection Agency (3 July, 2009). ""Health Protection Report"" (ภาษาEnglish). คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 18 November, 2010. สืบค้นเมื่อ 8 February, 2018.
{{cite web}}: ตรวจสอบค่าวันที่ใน:|accessdate=,|date=และ|archivedate=(help)CS1 maint: unrecognized language (ลิงก์) - ↑ McGann, Patrick; Snesrud, Erik; Maybank, Rosslyn; Corey, Brendan; Ong, Ana C.; Clifford, Robert; Hinkle, Mary; Whitman, Timothy; Lesho, Emil (26 May 2016). "Escherichia coli Harboring mcr-1 and blaCTX-M on a Novel IncF Plasmid: First report of mcr-1 in the USA". Antimicrobial Agents and Chemotherapy (ภาษาอังกฤษ). 60: AAC.01103–16. doi:10.1128/AAC.01103-16. ISSN 0066-4804. PMC 4914657. PMID 27230792.
- ↑ Moyer, Melinda Wenner. "Dangerous New Antibiotic-Resistant Bacteria Reach U.S." Scientific American. สืบค้นเมื่อ 27 May 2016.
- ↑ Marino PL (2007). The ICU book. "Antimicrobial therapy". Hagerstown, MD: Lippincott Williams & Wilkins. p. 817. ISBN 978-0-7817-4802-5.
- ↑ 177.0 177.1 177.2 Larson E (2007). "Community factors in the development of antibiotic resistance". Annu Rev Public Health. 28 (1): 435–447. doi:10.1146/annurev.publhealth.28.021406.144020. PMID 17094768.
{{cite journal}}: Cite ไม่รู้จักพารามิเตอร์ว่างเปล่า :|month=(help) - ↑ 178.0 178.1 Hawkey PM (2008). "The growing burden of antimicrobial resistance". J Antimicrob Chemother. 62 Suppl 1 (Supplement 1): i1–9. doi:10.1093/jac/dkn241. PMID 18684701.
{{cite journal}}: ไม่รู้จักพารามิเตอร์|month=ถูกละเว้น (help) - ↑ Ong S, Nakase J, Moran GJ, Karras DJ, Kuehnert MJ, Talan DA (2007). "Antibiotic use for emergency department patients with upper respiratory infections: prescribing practices, patient expectations, and patient satisfaction". Annals of Emergency Medicine. 50 (3): 213–20. doi:10.1016/j.annemergmed.2007.03.026. PMID 17467120.
{{cite journal}}: Cite ไม่รู้จักพารามิเตอร์ว่างเปล่า :|month=(help)CS1 maint: multiple names: authors list (ลิงก์) - ↑ Metlay JP, Camargo CA, MacKenzie T; และคณะ (2007). "Cluster-randomized trial". Annals of Emergency Medicine. 50 (3): 221–30. doi:10.1016/j.annemergmed.2007.03.022. PMID 17509729.
{{cite journal}}: Cite ไม่รู้จักพารามิเตอร์ว่างเปล่า s:|1=และ|month=(help); ใช้ et al. อย่างชัดเจน ใน|author=(help)CS1 maint: multiple names: authors list (ลิงก์) - ↑ Coxeter, Peter (11 November 2015). "Interventions to facilitate shared decision making to address antibiotic use for acute respiratory infections in primary care". Cochrane Database of Systematic Reviews. 11: CD010907. doi:10.1002/14651858.CD010907.pub2. PMID 26560888.
- ↑ Centers of Disease Control and Prevention (12 March, 2009). "Antibiotic / Antimicrobial Resistance". สืบค้นเมื่อ 11 February, 2018.
{{cite web}}: ตรวจสอบค่าวันที่ใน:|accessdate=และ|date=(help) - ↑ Keep Antibiotics Working (21 May, 2010). "Keep Antibiotics Working". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 18 November, 2010. สืบค้นเมื่อ 11 February, 2018.
{{cite web}}: ตรวจสอบค่าวันที่ใน:|accessdate=,|date=และ|archivedate=(help) - ↑ Sabuncu E, David J, Bernède-Bauduin C, Pépin S, Leroy M, Boëlle PY, Watier L, Guillemot D (2009). Klugman, Keith P. (บ.ก.). "Significant reduction of antibiotic use in the community after a nationwide campaign in France, 2002–2007". PLoS Med. 6 (6): e1000084. doi:10.1371/journal.pmed.1000084. PMC 2683932. PMID 19492093. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 18 November 2010.
{{cite journal}}: Cite ไม่รู้จักพารามิเตอร์ว่างเปล่า :|1=(help); ไม่รู้จักพารามิเตอร์|deadurl=ถูกละเว้น แนะนำ (|url-status=) (help)CS1 maint: uses authors parameter (ลิงก์) - ↑ "Regulation (EC) No 1831/2003 of the European Parliament and of the Council". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 9 January 2009.
{{cite web}}: ไม่รู้จักพารามิเตอร์|deadurl=ถูกละเว้น แนะนำ (|url-status=) (help) - ↑ "The Overuse of Antibiotics in Food Animals Threatens Public Health". Consumer Reports. สืบค้นเมื่อ 4 July 2016.[แหล่งอ้างอิงทางการแพทย์ที่ไม่น่าเชื่อถือ?]
- ↑ 187.0 187.1 GovTrack.us. "S. 742—109th Congress (2005): Preservation of Antibiotics for Medical Treatment Act of 2005, GovTrack.us (database of federal legislation)". สืบค้นเมื่อ 11 February, 2018.
{{cite web}}: ตรวจสอบค่าวันที่ใน:|accessdate=(help) - ↑ 188.0 188.1 GovTrack.us. "H.R. 2562—109th Congress (2005): Preservation of Antibiotics for Medical Treatment Act of 2005, GovTrack.us (database of federal legislation)". สืบค้นเมื่อ 11 February, 2018.
{{cite web}}: ตรวจสอบค่าวันที่ใน:|accessdate=(help) - ↑ "Kee Antibiotics Working" (PDF). คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 25 March 2009. สืบค้นเมื่อ 12 November 2008.
{{cite web}}: ไม่รู้จักพารามิเตอร์|deadurl=ถูกละเว้น แนะนำ (|url-status=) (help) - ↑ http://www.npr.org/sections/thesalt/2016/12/22/506599017/despite-pledges-to-cut-back-farms-are-still-using-antibiotics
- ↑ John Gever (23 March 2012). "FDA Told to Move on Antibiotic Use in Livestock". MedPage Today. สืบค้นเมื่อ 24 March 2012.
- ↑ 192.0 192.1 192.2 192.3 Gill, Erin E.; Franco, Octavio L.; Hancock, Robert E. W. (1 January 2015). "Antibiotic adjuvants: diverse strategies for controlling drug-resistant pathogens". Chemical Biology & Drug Design. 85 (1): 56–78. doi:10.1111/cbdd.12478. ISSN 1747-0285. PMC 4279029. PMID 25393203.
- ↑ 193.0 193.1 Sulakvelidze, A.; Alavidze, Z.; Morris, Jr J. G. (2001). "Bacteriophage Therapy". Antimicrob Agents Chemother. 45 (3): 649–659. doi:10.1128/aac.45.3.649-659.2001. PMC 90351. PMID 11181338.
- ↑ Opal, Steven M. (16 December 2016). "Non-antibiotic treatments for bacterial diseases in an era of progressive antibiotic resistance". Critical Care (London, England). 20 (1): 397. doi:10.1186/s13054-016-1549-1. ISSN 1466-609X. PMC 5159963. PMID 27978847.
- ↑ 195.0 195.1 Cowan, M. M. (1 October 1999). "Plant products as antimicrobial agents". Clinical Microbiology Reviews. 12 (4): 564–582. ISSN 0893-8512. PMC 88925. PMID 10515903.
- ↑ Abreu, Ana Cristina; McBain, Andrew J.; Simões, Manuel (1 September 2012). "Plants as sources of new antimicrobials and resistance-modifying agents". Natural Product Reports. 29 (9): 1007–1021. doi:10.1039/c2np20035j. ISSN 1460-4752. PMID 22786554.
- ↑ Moloney, Mark G. (1 August 2016). "Natural Products as a Source for Novel Antibiotics". Trends in Pharmacological Sciences. 37 (8): 689–701. doi:10.1016/j.tips.2016.05.001. ISSN 1873-3735. PMID 27267698.
- ↑ 198.0 198.1 Kenny, CR; Furey, A (2015). "A post-antibiotic era looms: can plant natural product research fill the void?". British Journal of Biomedical Science. 72 (4): 191–200. doi:10.1080/09674845.2015.11665752. PMID 26738402.
- ↑ 199.0 199.1 Monte, Joana; Abreu, Ana C.; Borges, Anabela; Simões, Lúcia Chaves; Simões, Manuel (18 June 2014). "Antimicrobial Activity of Selected Phytochemicals against Escherichia coli and Staphylococcus aureus and Their Biofilms". Pathogens (Basel, Switzerland). 3 (2): 473–498. doi:10.3390/pathogens3020473. PMC 4243457. PMID 25437810.
- ↑ Cushnie, T. P. Tim; Cushnie, Benjamart; Lamb, Andrew J. (1 November 2014). "Alkaloids: an overview of their antibacterial, antibiotic-enhancing and antivirulence activities". International Journal of Antimicrobial Agents. 44 (5): 377–386. doi:10.1016/j.ijantimicag.2014.06.001. ISSN 1872-7913. PMID 25130096.
- ↑ Al-Habib A; Al-Saleh, E (2010). "Bactericidal effect of grape seed extract on methicillin-resistant Staphylococcus aureus (MRSA)". Journal of Toxicology Science. 35 (3): 357–64. doi:10.2131/jts.35.357. PMID 20519844.
- ↑ Smullen, J.; Koutsou, G.A.; Foster, H.A.; Zumbé, A.; Storey, D.M. (2007). "The Antibacterial Activity of Plant Extracts Containing Polyphenols against Streptococcus mutans". Caries Research. 41 (5): 342–9. doi:10.1159/000104791. PMID 17713333.
- ↑ Cushnie TP, Lamb AJ (Aug 2011). "Recent advances in understanding the antibacterial properties of flavonoids". Int J Antimicrob Agents. 38 (2): 99–107. doi:10.1016/j.ijantimicag.2011.02.014. PMID 21514796.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Steenhuysen, Julie (18 April 2013). "Drug pipeline for worst superbugs 'on life support': report". Reuters. สืบค้นเมื่อ 23 June 2013.
- ↑ 205.0 205.1 Boucher HW, Talbot GH, Benjamin DK, Bradley J, Guidos RJ, Jones RN, Murray BE, Bonomo RA, Gilbert D (2013). Infectious Diseases Society of America. "10 x '20 Progress—development of new drugs active against gram-negative bacilli: an update from the Infectious Diseases Society of America". Clin. Infect. Dis. 56 (12): 1685–94. doi:10.1093/cid/cit152. PMC 3707426. PMID 23599308.
{{cite journal}}: CS1 maint: others (ลิงก์) CS1 maint: uses authors parameter (ลิงก์) - ↑ Achaogen, Inc. (October, 2017). "Plazomicin: the first clinical candidate from our gram-negative antibiotic discovery engine" (ภาษาEnglish). สืบค้นเมื่อ 12 February, 2018.
{{cite web}}: ตรวจสอบค่าวันที่ใน:|accessdate=และ|date=(help)CS1 maint: unrecognized language (ลิงก์) - ↑ Stynes, T. Tetraphase Pharma's Eravacycline Gets Qualified-Infectious-Disease-Product Status. Wall Street J. Monday, 15 July 2013.
- ↑ "Fact Sheet" (PDF). PolyMedix.
- ↑ Palermo, Edmund Francis (2011). "Antimicrobial Polymers: peptide-mimetic design and mechanism of action" (PDF). University of Michigan Library.
- ↑ Palermo, Edmund Francis (2011). "The convergence of peptide and polymer science toward novel antibiotics" (PDF). University of Michigan Library. 158pages
- ↑ Sgolastra, Dr. Frederica. "Design and synthesis of biomimetic compounds with pharmacological activity" (PDF). Universita' Politecnica Delle Marche.
- ↑ Kuroda, Kenichi; Caputo, Gregory (2013). "Antimicrobial polymers as synthetic mimics of host-defense peptides". Wiley Interdisciplinary Reviews: Nanomedicine and Nanobiotechnology. 5 (1): 49–66. doi:10.1021/bk-2013-1135.ch019.
- ↑ "Designing mimics of membrane active proteins" (PDF). Accounts of Chemical Research
- ↑ การศึกษาทางคลินิกหมายเลข NCT02324335 เรื่อง "Study of the Effects of Brilacidin Oral Rinse on Radiation-induced Oral Mucositis in Patients With Head and Neck Cancer (Brilacidin)" ที่ ClinicalTrials.gov
- ↑ Osbourn, Anne; Goss, Rebecca J.; Carter, Guy T. (28 March 2014). "Discovery and Development of NVB302, a Semisynthetic Antibiotic for Treatment of Clostridium difficile Infection". Natural Products: Discourse, Diversity, and Design. John Wiley & Sons, Inc.: 455–468. doi:10.1002/9781118794623.ch24. สืบค้นเมื่อ 19 January 2015.
- ↑ The Biotechnology and Biological Sciences Research Council (20 April, 2012). "Investing in world-class bioscience research and training on behalf of the UK public" (ภาษาEnglish). สืบค้นเมื่อ 12 February, 2018.
{{cite web}}: ตรวจสอบค่าวันที่ใน:|accessdate=และ|date=(help)CS1 maint: unrecognized language (ลิงก์) - ↑ Press Release (12 December 2013). "Green, Gingrey Introduce ADAPT Act to Safeguard Public Health". US Congress.
- ↑ "Antibiotic Development to Advance Patient Treatment Act of 2013" (PDF). US Congress. 12 December 2013.
- ↑ Clarke, Toni. "U.S. Congress urged to pass bill to speed development of antibiotics". Reuters. สืบค้นเมื่อ 19 September 2014.
- ^ The Merck Manual of Medical Information - Home Edition, Robert Berkow (Ed.) , Pocket (September, 1999) , ISBN 0-671-02727-1.
Further reading
แหล่งข้อมูลอื่น
- Antibiotic News from Genome News Network (GNN)
- Bruce Sterling's Bitter Resistance
- JAAPA: New antibiotics useful in primary care
- A new method for controlling bacterial activity without antibiotics - Research conducted at the Hebrew University
